
|
|
Ghi chú bài giảng, phiếu đánh giá
Hóa học vô cơ. Cheat sheet: ngắn gọn, quan trọng nhất
Cẩm nang / Ghi chú bài giảng, phiếu đánh giá Mục lục
1. Mối quan hệ giữa các quá trình chuyển hoá và năng lượng trong cơ thể. Hệ thống nhiệt động lực học Các quá trình sống trên Trái đất phần lớn là do sự tích tụ năng lượng mặt trời trong các chất sinh học (protein, chất béo, carbohydrate) và sự biến đổi tiếp theo của các chất này trong cơ thể sống với sự giải phóng năng lượng. Các công trình của A. M. Lavoisier (1743-1794) và P. S. Laplace (1749-1827) đã chỉ ra bằng các phép đo nhiệt lượng trực tiếp rằng năng lượng giải phóng trong quá trình sống được xác định bởi quá trình oxy hóa thực phẩm bằng oxy trong không khí mà động vật hít vào. Với sự phát triển trong các thế kỷ XIX-XX. nhiệt động lực học, người ta có thể tính toán định lượng sự chuyển đổi năng lượng trong các phản ứng sinh hóa và dự đoán hướng của chúng. Phương pháp nhiệt động lực học dựa trên một số khái niệm chặt chẽ: "hệ thống", "trạng thái của hệ thống", "nội năng của hệ thống", "hàm số trạng thái của hệ thống". hệ thống nhiệt động lực học bất kỳ đối tượng nào của tự nhiên được gọi là, bao gồm một số lượng đủ lớn các phân tử (đơn vị cấu trúc) và được ngăn cách với các đối tượng khác của tự nhiên bằng một bề mặt ranh giới thực hoặc ảo (mặt phân cách). Các đối tượng của tự nhiên không có trong hệ thống được gọi là môi trường. Các đặc điểm chung nhất của các hệ thống là m - khối lượng của chất chứa trong hệ thống và E - năng lượng bên trong của hệ thống. Khối lượng của chất trong hệ được xác định bằng tổng khối lượng của các phân tử chứa nó. Nội năng của hệ là tổng năng lượng chuyển động nhiệt của các phân tử và năng lượng tương tác giữa chúng. Các hệ thống theo tính chất trao đổi vật chất và năng lượng với môi trường được chia thành ba loại: cô lập, đóng và mở. hệ thống cách ly một hệ được gọi là không trao đổi vật chất hoặc năng lượng với môi trường (Δm = 0, ΔE = 0). Hệ kín là hệ không trao đổi vật chất với môi trường, nhưng có thể trao đổi năng lượng (Δm = 0, ΔE ^ 0). Sự trao đổi năng lượng có thể được thực hiện bằng cách truyền nhiệt hoặc thực hiện công. hệ thống mở một hệ được gọi là có thể trao đổi cả vật chất và năng lượng với môi trường (Δm ≠ 0, ΔE ≠ 0). Một ví dụ quan trọng của hệ thống mở là tế bào sống. Các hệ thống, tùy thuộc vào trạng thái tập hợp của chất mà chúng được tạo thành, được chia thành đồng nhất và không đồng nhất. Trong một hệ thống đồng nhất, không có những thay đổi mạnh mẽ về các tính chất vật lý và hóa học khi di chuyển từ khu vực này sang khu vực khác của hệ thống. Một ví dụ của hệ thống như vậy là huyết tương, là một dung dịch của các chất sinh học khác nhau. Một hệ thống không đồng nhất bao gồm hai hoặc nhiều phần đồng nhất. Một ví dụ về hệ thống không đồng nhất là máu toàn phần, nghĩa là huyết tương với các tế bào - hồng cầu và bạch cầu. 2. Định luật đầu tiên của nhiệt động lực học. Các khái niệm đặc trưng cho hệ thống Định luật đầu tiên của nhiệt động lực học cung cấp một khung định lượng nghiêm ngặt để phân tích năng lượng của các hệ thống khác nhau. Để hình thành nó, cần phải đưa ra một số khái niệm mới đặc trưng cho hệ thống. Một trong những khái niệm quan trọng nhất là trạng thái của hệ thống. Trạng thái được hiểu là một tập hợp các thuộc tính của một hệ thống giúp chúng ta có thể xác định hệ thống theo quan điểm của nhiệt động lực học. Là một đặc tính tổng quát của trạng thái của hệ, các khái niệm sau được sử dụng: "cân bằng", "tĩnh", "trạng thái chuyển tiếp". Trạng thái của hệ được gọi là trạng thái cân bằng nếu tất cả các thuộc tính không đổi trong bất kỳ khoảng thời gian lớn nào và không có dòng vật chất và năng lượng nào trong hệ. Nếu các thuộc tính của hệ là không đổi theo thời gian, nhưng có các dòng vật chất và năng lượng, trạng thái được gọi là dừng. Về mặt định lượng, các trạng thái được phân biệt với sự trợ giúp của các biến nhiệt động lực học. Các biến nhiệt động là những đại lượng đặc trưng cho trạng thái của toàn bộ hệ thống. Chúng còn được gọi là các thông số nhiệt động của hệ thống. Các biến nhiệt động quan trọng nhất là áp suất p, nhiệt độ T, thể tích của hệ thống V hoặc tổng khối lượng của hệ thống m, khối lượng hóa chất (thành phần) mk tạo nên hệ thống hoặc nồng độ của các chất này m. Cần lưu ý rằng các đặc điểm tương tự (nhiệt độ, trọng lượng, thành phần của chất lỏng sinh học, huyết áp) được bác sĩ sử dụng để xác định tình trạng của bệnh nhân. Sự chuyển đổi của một hệ thống từ trạng thái này sang trạng thái khác được gọi là quá trình. Kết quả của quá trình, trạng thái của hệ thống và các biến nhiệt động lực học thay đổi. Nếu ta ký hiệu giá trị của biến nhiệt động ở trạng thái ban đầu là Х1 , và cuối cùng - X2 , khi đó sự thay đổi của biến này tương ứng bằng ΔX = X2 -X1 và được gọi là số tăng của biến nhiệt X. Số gia lấy ngược dấu được gọi là số giảm của biến trở X. Nội năng của hệ E là một trong các hàm trạng thái nhiệt động. Một đặc điểm quan trọng của các chức năng trạng thái là tính độc lập của chúng với phương pháp đạt được một trạng thái nhất định của hệ thống. Sự thay đổi nội năng của hệ ΔE là do công W thực hiện trong quá trình tương tác của hệ với môi trường và sự trao đổi nhiệt Q giữa môi trường và hệ, tỉ số giữa các đại lượng này là nội dung của định luật đầu tiên của nhiệt động lực học. Độ tăng nội năng của hệ ΔE trong một quá trình nào đó bằng nhiệt lượng Q mà hệ nhận được, cộng với công W thực hiện đối với hệ trong quá trình này: ∆E = Q + W. Trong các hệ thống sinh học, nhiệt thường được hệ thống tỏa ra môi trường bên ngoài, và công việc được thực hiện bởi hệ thống do mất nội năng. Thuận tiện để biểu diễn bản ghi toán học của định luật đầu tiên của nhiệt động lực học dưới dạng: ∆E = Q - W. Tất cả các đại lượng trong các công thức trên được đo bằng jun (J). 3. Định luật đầu tiên của nhiệt động lực học Định luật đầu tiên của nhiệt động lực học là một trong những định luật cơ bản của tự nhiên không thể rút ra từ bất kỳ định luật nào khác. Tính giá trị của nó được chứng minh bằng nhiều thí nghiệm, đặc biệt là những nỗ lực không thành công trong việc chế tạo một cỗ máy chuyển động vĩnh viễn thuộc loại đầu tiên, tức là một cỗ máy có thể hoạt động trong một thời gian dài tùy ý mà không cần cung cấp năng lượng từ bên ngoài. Tùy thuộc vào các điều kiện của quá trình trong hệ thống, các hàm trạng thái khác nhau được sử dụng, các hàm này được suy ra từ định luật đầu tiên của nhiệt động lực học. Đồng thời, thay vì các hệ thống sinh học phức tạp, các mô hình đơn giản hóa được sử dụng để đưa ra kết luận về sự biến đổi của khối lượng và năng lượng. Áp suất trong hệ thống được duy trì không đổi, nó bằng áp suất bên ngoài. Các quá trình như vậy xảy ra ở p = const được gọi là đẳng áp. Công việc mở rộng được thực hiện trong một quá trình đẳng cấp được biết là: W = ρΔV, trong đó ΔV là độ tăng thể tích của hệ, bằng hiệu giữa các thể tích ở trạng thái 2 và 1. Thay công việc khai triển thành biểu thức toán học của định luật thứ nhất và thực hiện các phép biến đổi đơn giản, chúng ta thu được: Qρ = ΔE + pΔV = (E2 + ρV2)-(E1 +ρΔV1) trong đó Qρ là nhiệt của quá trình đẳng tích; 1, 2 - các chỉ số liên quan đến phần đầu và phần cuối của quá trình. Giá trị (E + pV) là một hàm của trạng thái của hệ thống, được ký hiệu là H và được gọi là entanpi: H = E + ρV. Theo đó, biểu thức có thể được viết dưới dạng: Qp = H2 - H1 = ∆H. Từ biểu thức này, nó theo sau rằng enthalpy - hàm trạng thái, gia số của nó bằng nhiệt lượng mà hệ nhận được trong quá trình đẳng tích. Việc đo sự gia tăng entanpi trong một quá trình nhất định có thể được thực hiện bằng cách thực hiện quá trình này trong nhiệt lượng kế ở áp suất không đổi. Đây là cách A. M. Lavoisier và P. S. Laplace thực hiện các thí nghiệm của họ, nghiên cứu năng lượng của quá trình trao đổi chất trong một cơ thể sống. Trong trường hợp sự thay đổi trạng thái của hệ xảy ra ở một thể tích không đổi, quá trình này được gọi là đẳng tích. Trong trường hợp này, sự thay đổi thể tích AV bằng 0, và theo công thức, công của khai triển W = XNUMX. Sau đó, từ biểu thức toán học của định luật đầu tiên của nhiệt động lực học, nó như sau: Qv = ∆E. Định nghĩa nhiệt động lực học dựa trên quan hệ trên: năng lượng bên trong - hàm trạng thái, số gia của nó bằng nhiệt QV mà hệ thu được trong quá trình đẳng tích. Do đó, sự thay đổi nội năng trong một quá trình nhất định có thể được đo bằng cách thực hiện quá trình này trong một nhiệt lượng kế ở thể tích không đổi. Theo đó, tại ρ = const, gia số của nội năng và entanpi có liên quan với nhau theo quan hệ: ∆H = ∆E + ρ∆V. 4. Luật Hess ' Phần nhiệt động lực học nghiên cứu sự chuyển hóa năng lượng trong các phản ứng hóa học được gọi là nhiệt động lực học hóa học. Phương trình phản ứng mà sự thay đổi nội năng ΔE, entanpi ΔH hoặc một số hàm trạng thái khác tương ứng với phản ứng này được chỉ ra được gọi là nhiệt hóa. Phản ứng hóa học trong đó entanpi của hệ giảm (ΔH <0) và nhiệt tỏa ra môi trường ngoài được gọi là tỏa nhiệt. Các phản ứng trong đó entanpi tăng (ΔH> 0) và hệ hấp thụ nhiệt Qp bên ngoài được gọi là thu nhiệt. Quá trình oxi hóa glucozơ bằng oxi xảy ra với việc giải phóng một lượng nhiệt lớn (Qp \u2800d XNUMX kJ / / mol), tức là quá trình này tỏa nhiệt. Phương trình nhiệt hóa tương ứng có thể được viết là С6 Н12 О6 + 602 = 6С02 + 6 giờ2ΔH = 2800 kJ. Các phản ứng xảy ra trong dung dịch thường kèm theo sự thay đổi nhỏ về thể tích của hệ, tức là ΔV ≈ 0. Về vấn đề này, trong nhiều trường hợp, trong tính toán sinh học, chúng ta có thể cho rằng ΔH = ΔE. Do đó, sự giải phóng nhiệt trong các hệ thống như vậy chủ yếu là do sự giảm nội năng do kết quả của phản ứng và ngược lại. Entanpi tạo thành hợp chất A là sự thay đổi entanpi của hệ ΔHA đi kèm với sự tạo thành 1 mol hợp chất A từ các chất đơn giản. Các entanpi của sự hình thành oxy, carbon, hydro và tất cả các chất nguyên tố (đơn giản) khác được giả định bằng không. Những thứ khác bằng nhau, nội năng và entanpi tỷ lệ với lượng vật chất trong hệ. Các hàm nhiệt động lực học như vậy được gọi là bao quát. Theo quan điểm của nhiệt động lực học, phản ứng có dạng tổng quát nAA + pВ = nС + khôngD , Δh là độ chuyển của hệ từ trạng thái ban đầu với entanpi H1 sang trạng thái 2 với entanpi H2. Sự thay đổi entanpi của hệ là kết quả của quá trình chuyển đổi này, được gọi là entanpi của phản ứng này, bằng hiệu số: ∆Hpya = H2 - H1 = (ncHc + khôngDHD) - (NАНА + khôngBHB). Định luật hằng số nhiệt được nhà hóa học người Nga G. I. Hess phát hiện năm 1840. Ông là người phát hiện ra khả năng ứng dụng của định luật nhiệt động lực học đầu tiên trong các phép biến đổi hóa học và là người sáng lập ra nhiệt động lực học hóa học. Hiện nay, định luật Hess được coi là hệ quả của định luật đầu tiên của nhiệt động lực học và được xây dựng như sau: độ tăng entanpi khi tạo thành các sản phẩm nhất định từ các thuốc thử đã cho ở áp suất không đổi không phụ thuộc vào số lượng và loại phản ứng tạo thành của các sản phẩm này. Trong các tính toán nhiệt hóa, không phải bản thân định luật Hess thường được sử dụng hơn, mà là hệ quả của nó, suy ra ở trên đối với trường hợp cụ thể của quá trình oxy hóa glucozơ ở dạng đẳng thức (2). Đối với một phản ứng được trình bày ở dạng tổng quát pАA + pвB = = nсC + nDD, hệ quả của định luật Hess được viết bằng cách sử dụng đẳng thức ΔHpya = (nC∆HC + khôngD∆HD) - (NA∆HA ++ nB∆HB ) và được xây dựng như sau: entanpi của phản ứng bằng tổng đại số của các entanpi của sự hình thành một lượng sản phẩm đẳng tích trừ đi tổng đại số của các entanpi tạo thành một lượng chất phản ứng. 5. Định luật thứ hai của nhiệt động lực học. Gibbs năng lượng miễn phí Cơ thể thực hiện công việc bằng cách sử dụng năng lượng bên trong được lưu trữ dưới dạng năng lượng tương tác hóa học của các nguyên tử của các chất cấu thành nó. Biểu thức toán học ΔE \uXNUMXd Q - W của định luật nhiệt động lực học thứ nhất xác định mối quan hệ chính xác giữa mức tiêu thụ năng lượng bên trong của hệ ΔЕ, công W do hệ thực hiện và năng lượng Q bị mất dưới dạng nhiệt. Tuy nhiên, từ định luật thứ nhất của nhiệt động lực học, không thể xác định được phần năng lượng bên trong đã tiêu hao có thể chuyển hóa thành công. Ước tính chi phí lý thuyết dựa trên định luật thứ hai của nhiệt động lực học. Luật này áp đặt các hạn chế nghiêm ngặt đối với hiệu quả của việc chuyển đổi năng lượng thành công việc và ngoài ra, cho phép bạn đưa ra các tiêu chí về khả năng xảy ra dòng chảy tự phát của một quy trình. Quá trình này được gọi là tự phátnếu nó được thực hiện mà không có bất kỳ ảnh hưởng nào, khi hệ thống được để cho chính nó. Có những quá trình mà nội năng của hệ không thay đổi (ΔE = 0). Các quá trình như vậy bao gồm, ví dụ, quá trình ion hóa axit axetic trong nước. Một số quá trình tự phát xảy ra với sự gia tăng nội năng (ΔE> 0). Đặc biệt, điều này bao gồm các phản ứng điển hình của việc hình thành các hợp chất vô cơ sinh học của albumin (protein huyết tương) với các ion kim loại, chẳng hạn như Cu2+. Sự thay đổi AE năng lượng bên trong đối với các hệ thống kín không thể dùng làm tiêu chí cho các quá trình tự phát. Do đó, định luật đầu tiên của nhiệt động lực học, từ tiêu chí này được suy ra, không đủ để giải quyết câu hỏi về tính tự phát, cũng như hiệu quả của các quá trình. Giải pháp của những câu hỏi này đạt được với sự trợ giúp của định luật thứ hai của nhiệt động lực học. Để hình thành định luật thứ hai của nhiệt động lực học, cần đưa ra các khái niệm về các quá trình thuận nghịch và không thuận nghịch theo nghĩa nhiệt động lực học. Nếu hệ ở trạng thái cân bằng, trạng thái này được duy trì vô thời hạn trong cùng các điều kiện bên ngoài. Khi các điều kiện bên ngoài thay đổi, trạng thái của hệ thống có thể thay đổi, tức là một quá trình có thể diễn ra trong hệ thống. Một quá trình được cho là thuận nghịch về mặt nhiệt động lực học nếu trong quá trình chuyển từ trạng thái đầu 1 sang trạng thái cuối 2, tất cả các trạng thái trung gian đều ở trạng thái cân bằng. Một quá trình được gọi là không thể đảo ngược về mặt nhiệt động lực học nếu ít nhất một trong các trạng thái trung gian là không cân bằng. Quá trình thuận nghịch chỉ có thể được thực hiện với sự thay đổi đủ chậm trong các tham số của hệ thống - nhiệt độ, áp suất, nồng độ của các chất, v.v. Tốc độ thay đổi của các tham số phải sao cho độ lệch khỏi trạng thái cân bằng xảy ra trong quá trình là không đáng kể. Cần lưu ý rằng một vấn đề quan trọng trong y học có liên quan đến khả năng đảo ngược - việc bảo quản các mô ở nhiệt độ thấp. Các quá trình thuận nghịch là trường hợp giới hạn của các quá trình thực xảy ra trong tự nhiên và được thực hiện trong công nghiệp hoặc trong phòng thí nghiệm. 6. Định luật thứ hai của nhiệt động lực học. Sự hỗn loạn Công việc tối đa Wмакс, có thể đạt được với sự mất mát nội năng ΔE nhất định trong quá trình chuyển từ trạng thái 1 sang trạng thái 2, chỉ đạt được nếu quá trình này là thuận nghịch. Phù hợp với biểu thức của định luật đầu tiên của nhiệt động lực học, nhiệt lượng nhỏ nhất Qphút Qphút \ uXNUMXd ΔE - Wмакс . Hệ số hiệu suất lớn nhất có thể đạt được, đặc trưng cho hiệu suất chi phí của nội năng của hệ thống, tương ứng bằng ηмакс=Wмакс / ΔE. Trong một quá trình chuyển đổi từ trạng thái 1 sang trạng thái 2 không thể đảo ngược, công do hệ thực hiện nhỏ hơn W. Để tính hệ số lớn nhất hмакс với giá trị đã biết của ΔE thì cần biết giá trị của Wмакс hoặc Qphút Wмакс = ΔE - Qphút , do đó, ηмакс \u1d XNUMX - ΔE / Qphút . Giá trị Qphút có thể được tính toán từ định luật thứ hai của nhiệt động lực học bằng cách sử dụng một hàm trạng thái nhiệt động lực học gọi là entropy. Khái niệm entropy được đưa ra (1865) bởi nhà vật lý người Đức R. Yu. Clausius (1822-1888), một trong những người sáng lập ra nhiệt động lực học và lý thuyết động học phân tử của các quá trình nhiệt. Định nghĩa nhiệt động học của entropi theo Clausius: entropy là một hàm trạng thái mà gia số ΔS bằng nhiệt Qphút đưa đến hệ trong một quá trình đẳng nhiệt thuận nghịch, chia cho nhiệt độ tuyệt đối T tại đó thực hiện quá trình: ∆S = Qphút / T. Theo công thức, đơn vị của entropy là J / K. Một ví dụ về quá trình đẳng nhiệt thuận nghịch là sự tan chảy chậm của nước đá trong bình thủy chứa đầy nước ở 273°K. Người ta đã chứng minh bằng thực nghiệm rằng để làm tan chảy 1 mol nước đá (18 g), cần cung cấp ít nhất 6000 J nhiệt. Trong trường hợp này, entropy của hệ "nước đá - nước đá" trong bình thủy điện tăng thêm ΔS = 6000 J: 273°K = 22 J/K. Khi một phích đựng nước được làm lạnh ở 273 ° K, nhiệt lượng 6000 J có thể được loại bỏ từ từ và 1 mol nước đá được hình thành trong quá trình kết tinh của nước. Đối với quá trình này, Qphút trong công thức là âm. Theo đó, entropi của hệ "nước đá - nước đá" trong quá trình hình thành 1 mol nước đá giảm đi một lượng ΔS = 22 J/K. Tương tự, có thể tính toán sự thay đổi entropi đối với bất kỳ quá trình vật lý và hóa học đẳng nhiệt nào, nếu biết nhiệt lượng cung cấp cho hệ thống hoặc loại bỏ nhiệt lượng ra khỏi hệ thống trong các quá trình này. Như đã biết từ vật lý, nhiệt lượng này có thể được xác định bằng cách sử dụng các phép đo nhiệt lượng. Do đó, sự thay đổi entropy, cũng như hai chức năng khác của trạng thái hệ thống - năng lượng bên trong và entanpy, là một đại lượng được xác định bằng thực nghiệm. Ý nghĩa vật lý của entropy, cũng như nội năng, được bộc lộ rõ ràng khi xem xét các quá trình xảy ra trong các hệ cô lập theo quan điểm động học phân tử. 7. Công thức Boltzmann Các hệ thống biệt lập, theo định nghĩa, không trao đổi vật chất hoặc năng lượng với môi trường. Tất nhiên, những hệ thống như vậy không thực sự tồn tại trong tự nhiên. Tuy nhiên, có thể đạt được cách nhiệt rất tốt bằng cách đặt hệ thống trong một phích nước được bịt kín bằng nút chai. Nó chỉ ra rằng bất kỳ quá trình tự phát nào cũng có thể diễn ra trong một hệ thống cô lập chỉ khi nó được đặc trưng bởi sự gia tăng entropi; ở trạng thái cân bằng, entropi của hệ không đổi: ∆S ≥ 0. Phát biểu này, dựa trên các quan sát thực nghiệm, là một trong những công thức khả dĩ của định luật thứ hai của nhiệt động lực học. Theo định luật thứ hai của nhiệt động lực học, một quá trình nghịch đảo với tự phát, không thể tiến hành trong một hệ cô lập, vì một quá trình như vậy được đặc trưng bởi sự giảm entropi. Một cuộc kiểm tra các hệ thống cô lập khác nhau cho thấy rằng các quá trình tự phát luôn có liên quan đến sự gia tăng số lượng vi hạt w của hệ thống. Trong các quá trình tương tự, entropi S của hệ thống tăng lên, tức là entropi tăng lên khi số lượng các microstate tăng lên. Lần đầu tiên, sự tồn tại của một sự phụ thuộc như vậy được chú ý bởi nhà vật lý người Áo L. Boltzmann, người vào năm 1872 đã đề xuất mối quan hệ: КБ =R/NA = 1,38 - 1023 J / K, nơi KБ - Hằng số Boltzmann, bằng tỷ số của hằng số khí R với hằng số Avogadro NA . Mối quan hệ này được gọi là công thức Boltzmann. Công thức Boltzmann giúp ta có thể tính toán lý thuyết entropy của một hệ từ số lượng các vi hạt có thể có của nó. Các tính toán như vậy phù hợp tốt với các giá trị được xác định bằng thực nghiệm. Đặc biệt, người ta biết rằng số lượng vi tinh thể của chất kết tinh ở 0 ° K gần bằng w0 “1. Như vậy có thể xác định được các giá trị tuyệt đối của entropi của các chất kết tinh, ngược lại với nội năng E và entanpi H chỉ xác định được các giá trị tương đối. Sự gia tăng số lượng các vi hạt của một hệ thống trong nhiều trường hợp có thể liên quan đến sự gia tăng rối loạn trong hệ thống này, với sự chuyển đổi sang các phân phối năng lượng có thể xảy ra hơn của hệ thống. Dựa trên quan hệ Boltzmann, người ta có thể đưa ra định nghĩa động học-phân tử của entropy. Entropy là một thước đo xác suất của một hệ thống ở một trạng thái nhất định hoặc một thước đo sự rối loạn của hệ thống. Tầm quan trọng của khái niệm entropi là do trên cơ sở giá trị này có thể dự đoán hướng của các quá trình tự phát. Tuy nhiên, khả năng áp dụng của phép đo entropi như một tiêu chí cho hướng của các quá trình bị giới hạn trong các hệ thống cô lập phù hợp với công thức của định luật thứ hai của nhiệt động lực học. 8. Năng lượng Gibbs Một hàm trạng thái mới, năng lượng Gibbs, được giới thiệu như một tiêu chí cho tính tự phát của các quá trình trong các hệ thống mở và đóng. Hàm này được đặt theo tên của nhà vật lý vĩ đại người Mỹ DW Gibbs (1839-1903), người đã tìm ra hàm này và sau đó sử dụng nó trong công việc nhiệt động lực học. Năng lượng Gibbs được xác định theo entanpi H và entropi S bằng cách sử dụng các mối quan hệ: G = H - S, ∆G = ∆H - ∆S. Dựa trên năng lượng Gibbs, định luật thứ hai của nhiệt động lực học có thể được xây dựng như sau: trong điều kiện đẳng nhiệt đẳng áp (p, T = const), chỉ những quá trình như vậy mới có thể xảy ra tự phát trong hệ, do đó năng lượng Gibbs của hệ giảm (ΔG <0). Ở trạng thái cân bằng, năng lượng Gibbs của hệ hệ thống không thay đổi (G = const, AG = 0). ΔG <0, p, T = const. Từ những điều đã nói ở trên, năng lượng Gibbs đóng một vai trò quan trọng trong việc nghiên cứu các quá trình năng lượng sinh học. Với chức năng trạng thái này, bạn có thể dự đoán hướng của các quá trình tự phát trong hệ thống sinh học và tính toán hiệu quả tối đa có thể đạt được. Năng lượng Gibbs G, giống như entanpi H, là một hàm của trạng thái của hệ thống. Do đó, sự thay đổi năng lượng Gibbs ΔG có thể được sử dụng để mô tả các biến đổi hóa học theo cách tương tự như sự thay đổi entanpi ΔН. Các phương trình phản ứng mà sự thay đổi năng lượng Gibbs tương ứng với các phản ứng này được chỉ ra còn được gọi là nhiệt hóa. Các phản ứng hóa học, trong đó năng lượng Gibbs của hệ giảm (ΔG <0) và công việc được thực hiện, được gọi là phản ứng ngoại lực. Các phản ứng, do đó năng lượng Gibbs tăng lên (ΔG> 0) và công việc được thực hiện trên hệ thống, được gọi là endergonic. Bắt nguồn từ định luật thứ hai của nhiệt động lực học, năng lượng Gibbs là một hàm của trạng thái. Do đó, cũng như đối với entanpi, định luật Hess cho năng lượng Gibbs có thể được xây dựng ở dạng sau: sự thay đổi năng lượng Gibbs trong quá trình hình thành các sản phẩm nhất định từ các thuốc thử đã cho ở áp suất và nhiệt độ không đổi không phụ thuộc vào số lượng và loại phản ứng dẫn đến sự hình thành các sản phẩm này. Một ví dụ quan trọng của việc áp dụng định luật Hess là tính năng lượng Gibbs của phản ứng oxy hóa glucozo với dioxygen. Sự thay đổi năng lượng Gibbs trong phản ứng này ở p = 101 kPa và T = 298 ° K, được xác định bên ngoài cơ thể, là ΔG ° = 2880 kJ / mol. Phương trình nhiệt hóa tương ứng được viết dưới dạng: С6Н12О6 + 6O2 = 6CO2 + 6 giờ2Ồ, ΔGpya° = 2880 kJ / mol. Trong các tế bào của cơ thể, phản ứng này được thực hiện qua một số giai đoạn kế tiếp nhau do các nhà sinh hóa học nghiên cứu. Có thể dự đoán từ định luật Hess rằng tổng của sự thay đổi năng lượng Gibbs trong tất cả các phản ứng trung gian là ΔGpya: ∆G1 +ΔG2 +ΔG3 +… + ∆Gn = ∆Gpya °. Năng lượng Gibbs của một phản ứng bằng tổng đại số của năng lượng Gibbs tạo thành một lượng sản phẩm đẳng tích trừ đi tổng đại số của năng lượng Gibbs để hình thành một lượng chất phản ứng: ∆Gpya = (nc∆Gc + khôngD∆GD)(NA∆GA + khôngB∆GB). 9. Giải pháp. Phân loại các giải pháp Theo trạng thái tập hợp, các dung dịch có thể ở thể khí, lỏng và rắn. Bất kỳ dung dịch nào cũng bao gồm chất tan và dung môi, mặc dù những khái niệm này hơi tùy tiện. Ví dụ, tùy thuộc vào tỷ lệ giữa lượng cồn và nước, hệ thống này có thể là dung dịch cồn trong nước hoặc nước trong cồn. Thông thường, dung môi được coi là thành phần có trong dung dịch ở trạng thái kết tụ giống như trước khi hòa tan. Học thuyết về các giải pháp được các bác sĩ đặc biệt quan tâm vì các chất lỏng sinh học quan trọng nhất - máu, bạch huyết, nước tiểu, nước bọt, mồ hôi - là các dung dịch muối, protein, carbohydrate, lipid trong nước. Chất lỏng sinh học tham gia vào việc vận chuyển các chất dinh dưỡng (chất béo, axit amin, oxy), thuốc đến các cơ quan và mô, cũng như bài tiết các chất chuyển hóa (urê, bilirubin, carbon dioxide, v.v.) ra khỏi cơ thể. Huyết tương là môi trường cho các tế bào - tế bào lympho, hồng cầu, tiểu cầu. Trong môi trường lỏng của cơ thể, hằng số của độ chua, nồng độ của muối và các chất hữu cơ được duy trì. Hằng số này được gọi là cân bằng nội môi nồng độ. Phân loại các giải pháp Dung dịch các chất có khối lượng mol nhỏ hơn 5000 g/mol gọi là dung dịch các hợp chất có khối lượng phân tử thấp (NMS), dung dịch các chất có khối lượng mol lớn hơn 5000 g/mol gọi là dung dịch các hợp chất cao phân tử (HMC). Theo sự hiện diện hay vắng mặt của sự phân ly điện phân, các dung dịch NMS được chia thành hai loại - dung dịch chất điện phân và chất không điện phân. Dung dịch điện phân - dung dịch của muối, axit, bazơ, chất lưỡng tính phân ly thành ion. Ví dụ, các giải pháp KNO3, HCl, KOH, Al (OH)3 , glyxin. Độ dẫn điện của dung dịch điện li cao hơn độ dẫn điện của dung môi. Dung dịch của chất không điện ly - dung dịch của các chất thực tế không phân ly trong nước. Ví dụ: dung dịch sacaroza, glucoza, urê. Độ dẫn điện của dung dịch không điện ly khác rất ít so với độ dẫn điện của dung môi. Các giải pháp của NMS (chất điện ly và chất không điện giải) được gọi là đúng, ngược lại với các dung dịch keo. Các dung dịch thật được đặc trưng bởi thành phần đồng nhất và không có mặt phân cách giữa chất tan và dung môi. Kích thước của các hạt hòa tan (ion và phân tử) nhỏ hơn 109m Hầu hết các vòng tránh thai là các polyme mà phân tử (đại phân tử) bao gồm một số lượng lớn các nhóm lặp lại hoặc các đơn vị đơn phân liên kết với nhau bằng các liên kết hóa học. Dung dịch IUD được gọi là dung dịch polyelectrolyte. Polyelectrolytes bao gồm polyacids (heparin, polyadenylic acid, polyaspartic acid, v.v.), polybases (polylysine), polyampholytes (protein, axit nucleic). Các thuộc tính của các giải pháp HMS khác biệt đáng kể so với các thuộc tính của các giải pháp NMS. Do đó, chúng sẽ được thảo luận trong một phần riêng biệt. Chương này được dành cho các giải pháp của chất điện phân trọng lượng phân tử thấp, chất lưỡng tính và chất không điện ly. 10. Nước làm dung môi Dung môi phổ biến nhất trên hành tinh của chúng ta là nước. Cơ thể của một người trung bình nặng 70 kg chứa khoảng 40 kg nước. Đồng thời, khoảng 25 kg nước rơi vào chất lỏng bên trong tế bào, và 15 kg là dịch ngoại bào, bao gồm huyết tương, dịch gian bào, dịch não tủy, dịch nội nhãn và các chất lỏng trong đường tiêu hóa. Ở sinh vật động thực vật, nước thường hơn 50%, có trường hợp hàm lượng nước lên tới 90-95%. Do đặc tính dị thường của nó, nước là một dung môi độc đáo, thích nghi hoàn hảo cho sự sống. Trước hết, nước hòa tan tốt các hợp chất ion và nhiều phân cực. Tính chất này của nước phần lớn là do hằng số điện môi cao (78,5). Một nhóm lớn các chất khác có khả năng hòa tan cao trong nước bao gồm các hợp chất hữu cơ phân cực như đường, andehit, xeton và rượu. Khả năng hòa tan của chúng trong nước được giải thích do xu hướng của các phân tử nước tạo liên kết phân cực với các nhóm chức phân cực của những chất này, ví dụ, với nhóm hydroxyl của rượu và đường hoặc với nguyên tử oxy của nhóm cacbonyl của anđehit và xeton. Sau đây là những ví dụ về liên kết hydro quan trọng đối với sự hòa tan của các chất trong hệ thống sinh học. Do có tính phân cực cao, nước gây ra sự thủy phân của các chất. Vì nước là thành phần chính của môi trường bên trong cơ thể, cung cấp cho quá trình hấp thụ, vận động các chất dinh dưỡng và các sản phẩm trao đổi chất trong cơ thể. Cần lưu ý rằng nước là sản phẩm cuối cùng của quá trình oxy hóa sinh học các chất, đặc biệt là glucose. Sự hình thành nước do các quá trình này đi kèm với việc giải phóng một lượng lớn năng lượng - khoảng 29 kJ / mol. Các tính chất dị thường khác của nước cũng rất quan trọng: sức căng bề mặt cao, độ nhớt thấp, nhiệt độ nóng chảy và điểm sôi cao, và tỷ trọng ở trạng thái lỏng cao hơn ở trạng thái rắn. Nước được đặc trưng bởi sự hiện diện của các liên kết - các nhóm phân tử được kết nối bằng liên kết hydro. Tùy thuộc vào ái lực của chúng với nước, các nhóm chức năng của các hạt hòa tan được chia thành ưa nước (hút nước), dễ hòa tan với nước, kỵ nước (đẩy nước) và lưỡng tính. Nhóm ưa nước bao gồm các nhóm chức phân cực: hydroxyl -OH, amino -NH2 , thiol -SH, cacboxyl -COOH. Đối với nhóm kỵ nước - không phân cực, ví dụ gốc hiđrocacbon: CHXNUMX- (CH2)п -, TỪ6Н5 -. Amino axit gồm những chất (axit amin, protein) mà phân tử có chứa cả nhóm háo nước (-OH, -NH2 , -SH, -COOH) và các nhóm kỵ nước: (CH3 - (CH2)п ,-TỪ6Н5🇧🇷 Khi các chất amphiphilic bị hòa tan, cấu trúc của nước thay đổi do tương tác với các nhóm kỵ nước. Mức độ sắp xếp thứ tự của các phân tử nước nằm gần các nhóm kỵ nước tăng lên, và sự tiếp xúc của các phân tử nước với các nhóm kỵ nước được giảm thiểu. Các nhóm kỵ nước, liên kết, đẩy các phân tử nước ra khỏi khu vực vị trí của chúng. 11. Nồng độ của dung dịch và cách biểu thị Giải pháp Một hệ đồng nhất có thành phần biến thiên của hai hay nhiều chất ở trạng thái cân bằng được gọi là. Các chất tạo nên dung dịch được gọi là thành phần dung dịch. Một đặc tính quan trọng của dung dịch là nồng độ của nó. Giá trị này xác định nhiều thuộc tính của giải pháp. Nồng độ chất (thành phần dung dịch) là đại lượng đo bằng lượng chất tan có trong một khối lượng hoặc thể tích nhất định của dung dịch, dung môi. Các cách biểu thị nồng độ thường được sử dụng là: phần khối lượng, nồng độ mol, nồng độ đương lượng mol, phần mol, phần thể tích, hiệu giá. Phần khối lượng W(NS) được biểu thị bằng phần nhỏ của một đơn vị, phần trăm (%), ppm (một phần nghìn của phần trăm) và phần triệu (ppm). Phần khối lượng được tính theo công thức: W(NS) = tôi(NS)/ m (pp), W(NS) = tôi(NS)/ m (pp) × 100%, nơi tôi(NS) - khối lượng của thành phần X (chất tan) đã cho, kg (g); m (pp) là khối lượng của dung dịch, kg (g). Nồng độ mol được biểu thị bằng mol / m3 , mol / dm3 , mol / cm3 , mol / l, mol / ml. Trong y học, việc sử dụng đơn vị mol / l được ưu tiên hơn. Nồng độ mol được tính theo công thức: C(NS) =n(X)/V(trang) = tôi(NS)/M(NS) ×V(rr), nơi n(X) - lượng chất hòa tan của hệ, mol; M(NS) là khối lượng mol của chất tan, kg / mol hoặc g / mol; m(NS) lần lượt là khối lượng của chất bị hòa tan, kg hoặc g; V(rr) - khối lượng dung dịch, l. nồng độ mol b(NS) được biểu thị bằng đơn vị mol / kg. Dạng ghi, ví dụ: b (HCl) \ u0,1d XNUMX mol / kg. Tính nồng độ mol theo công thức: b(NS) =n(X)/m(rl) = tôi(NS)/M(NS) ×m(rl) nơi tôi(rl) - khối lượng dung môi, kg. Trong hóa học, khái niệm đương lượng và hệ số đương lượng được sử dụng rộng rãi. Tương đương một hạt thực tế hoặc có điều kiện của chất X được gọi là hạt trong một phản ứng axit-bazơ nhất định tương đương với một ion hydro hoặc trong một phản ứng oxi hóa khử nhất định - với một electron hoặc trong một phản ứng trao đổi nhất định giữa các muối - với một đơn vị điện tích. Phần thể tích(X) được biểu thị dưới dạng phân số của một đơn vị hoặc dưới dạng phần trăm, nó được tính theo công thức: Ф(X) = V(NS)/ v(rr) ở đâu v(NS) - thể tích thành phần X này của dung dịch; V(rr) là tổng thể tích của dung môi. Bậc của dung dịch được ký hiệu là T(X), đơn vị đo - kg / cm3 , g / cm3 , g / ml. Giá trị của dung dịch có thể được tính theo công thức: Т(X) = tôi(NS)/ v(rr) nơi tôi(NS) là khối lượng của chất, thường là g; V(rr) thể tích dung dịch, ml. 12. Quá trình giải thể Bản chất của quá trình hòa tan là phức tạp. Đương nhiên, câu hỏi đặt ra tại sao một số chất dễ hòa tan trong một số dung môi và hòa tan kém hoặc thực tế không hòa tan trong một số chất khác. Sự hình thành dung dịch luôn gắn liền với những quá trình vật lý nhất định. Một trong những quá trình như vậy là sự khuếch tán của một chất tan và một dung môi. Do hiện tượng khuếch tán, các phần tử (phân tử, ion) bị bứt ra khỏi bề mặt chất hòa tan và phân bố đều khắp thể tích của dung môi. Đó là lý do tại sao, trong trường hợp không có khuấy, tốc độ hòa tan phụ thuộc vào tốc độ khuếch tán. Tuy nhiên, không thể giải thích sự hòa tan không bằng nhau của các chất trong các dung môi khác nhau chỉ bằng các quá trình vật lý. Nhà hóa học vĩ đại người Nga D. I. Mendeleev (1834-1907) tin rằng các quá trình hóa học đóng một vai trò quan trọng trong sự hòa tan. Ông đã chứng minh sự tồn tại của các hyđrat axit sunfuric H2VÌ THẾ4H2Ồ2VÌ THẾ42H2Ồ2VÌ THẾ44H2O và một số chất khác, ví dụ, C2Н5OH3H2A. Trong những trường hợp này, sự hòa tan đi kèm với sự hình thành liên kết hóa học giữa các phân tử của chất tan và dung môi. Quá trình này được gọi là solvat hóa, trong trường hợp cụ thể khi dung môi là nước, hydrat hóa. Như đã thiết lập, tùy thuộc vào bản chất của chất tan, các solvat (hydrat) có thể được hình thành do các tương tác vật lý: tương tác ion-lưỡng cực (ví dụ: khi hòa tan các chất có cấu trúc ion (NaCI, v.v.); tương tác lưỡng cực-lưỡng cực - khi hòa tan các chất có cấu trúc phân tử (chất hữu cơ)). Các tương tác hóa học được thực hiện do liên kết người cho - người nhận. Ở đây, các ion chất tan là chất nhận điện tử và dung môi (Н2Ôi NH3) - chất cho điện tử (ví dụ: sự hình thành phức hợp nước), cũng như là kết quả của sự hình thành liên kết hydro (ví dụ: sự hòa tan của rượu trong nước). Bằng chứng về tương tác hóa học của chất tan với dung môi được cung cấp bởi hiệu ứng nhiệt và sự thay đổi màu sắc kèm theo sự hòa tan. Ví dụ, khi hòa tan kali hydroxit trong nước, nhiệt sẽ tỏa ra: KOH + xN2O \ uXNUMXd KOH (N2Ồ; ΔH °dung dịch = 55 kJ / mol. Và khi natri clorua bị hòa tan, nhiệt được hấp thụ: NaCI + xH2O = NaCl (H2Ồ; ΔH °dung dịch = +3,8 kJ / mol. Nhiệt lượng toả ra hoặc bị hấp thụ khi 1 mol chất bị hoà tan gọi là nhiệt dung dịch Qdung dịch Theo định luật đầu tiên của nhiệt động lực học Qdung dịch = ΔHdung dịch, ở đâu ΔHdung dịch là sự thay đổi entanpi khi hòa tan một lượng chất nhất định. Sự hòa tan của đồng sunfat khan màu trắng trong nước dẫn đến sự xuất hiện của màu xanh lam đậm. Sự hình thành các solvat, sự thay đổi màu sắc, hiệu ứng nhiệt cũng như một số yếu tố khác cho thấy sự thay đổi bản chất hóa học của các thành phần của dung dịch trong quá trình hình thành. Như vậy, theo quan niệm hiện đại, hòa tan là một quá trình hóa lý, trong đó các loại tương tác vật lý và hóa học đều có vai trò. 13. Nhiệt động học của quá trình hòa tan Theo định luật thứ hai của nhiệt động lực học, tại p, T = const, các chất có thể tan một cách tự nhiên trong bất kỳ dung môi nào nếu kết quả của quá trình này, năng lượng Gibbs của hệ giảm, tức là ΔG = (ΔН - TΔS) <0. Giá trị của ΔН được gọi là hệ số entanpi, và giá trị của TΔS được gọi là hệ số hòa tan entropi. Khi hòa tan các chất lỏng và rắn, entropi của hệ thường tăng (ΔS> 0), vì các chất hòa tan chuyển từ trạng thái có trật tự hơn sang trạng thái có trật tự thấp hơn. Sự đóng góp của yếu tố entropy, góp phần làm tăng độ hòa tan, đặc biệt đáng chú ý ở nhiệt độ cao, bởi vì trong trường hợp này yếu tố T lớn và giá trị tuyệt đối của sản phẩm TΔS cũng lớn, tương ứng, sự giảm Gibbs năng lượng tăng lên. Khi hòa tan các chất khí trong chất lỏng, entropi của hệ thường giảm (ΔS <0), vì chất tan chuyển từ trạng thái có trật tự ít hơn (thể tích lớn) sang trạng thái có trật tự hơn (thể tích nhỏ). Sự giảm nhiệt độ tạo điều kiện cho sự hòa tan của các chất khí, vì trong trường hợp này hệ số T nhỏ và giá trị tuyệt đối của tích TΔS sẽ càng nhỏ, và sự giảm năng lượng Gibbs sẽ càng lớn, giá trị T càng thấp. Trong quá trình tạo thành dung dịch, entanpi của hệ cũng có thể tăng (NaCl) và giảm (KOH). Sự thay đổi entanpi của quá trình hòa tan phải được coi là theo định luật Hess như là tổng đại số của đóng góp endo và tỏa nhiệt của tất cả các quá trình đi kèm với quá trình hòa tan. Đó là các hiệu ứng thu nhiệt của việc phá hủy mạng tinh thể của các chất, phá vỡ liên kết của các phân tử, phá hủy cấu trúc ban đầu của dung môi và các hiệu ứng tỏa nhiệt của việc hình thành các sản phẩm tương tác khác nhau, bao gồm cả các chất tan. Để trình bày đơn giản, sự gia tăng của entanpi hòa tan ΔНdung dịch có thể được biểu diễn dưới dạng chênh lệch năng lượng Ecr, dành cho sự phá hủy mạng tinh thể của chất hòa tan và năng lượng Esol, được giải phóng trong quá trình phân hủy các hạt chất tan bởi các phân tử dung môi. Nói cách khác, sự thay đổi entanpi là tổng đại số của sự thay đổi entanpi ΔHcr do sự phá hủy mạng tinh thể và sự thay đổi entanpi ΔНsol do quá trình solvat hóa bởi các hạt dung môi: ΔNdung dịch = ΔHcr + ΔHsol, ở đâu ΔHdung dịch - sự thay đổi entanpi trong quá trình hòa tan. Tuy nhiên, sự hòa tan các khí cao trong dung môi hữu cơ thường kèm theo sự hấp thụ nhiệt, ví dụ, heli và neon trong axeton, benzen, etanol và xyclohexan. Khi hòa tan chất rắn có cấu trúc tinh thể phân tử và chất lỏng, liên kết phân tử không mạnh lắm, và do đó thường ΔHsol > ΔNcr Điều này dẫn đến thực tế là sự hòa tan, ví dụ, rượu và đường là một quá trình tỏa nhiệt (ΔНdung dịch <0). Khi hòa tan chất rắn bằng mạng tinh thể ion thì tỉ lệ năng lượng Ecr và Esol có thể khác. Tuy nhiên, trong hầu hết các trường hợp, năng lượng giải phóng trong quá trình solvat hóa của các ion không bù đắp được năng lượng dành cho việc phá hủy mạng tinh thể, do đó, quá trình hòa tan là thu nhiệt. Do đó, dữ liệu nhiệt động lực học có thể dự đoán sự hòa tan tự phát của các chất khác nhau dựa trên định luật thứ nhất và thứ hai của nhiệt động lực học. 14. Độ hòa tan Nếu một chất tan tiếp xúc với dung môi, quá trình hình thành dung dịch trong nhiều trường hợp diễn ra một cách tự phát cho đến khi đạt đến một nồng độ giới hạn nhất định (xảy ra bão hòa). Điều này xảy ra khi đạt tới trạng thái cân bằng, khi hệ số entanpi và entropi bằng nhau, tức là ΔН = TΔS. Ví dụ, khi tinh thể được đưa vào chất lỏng, các phân tử hoặc ion đi từ bề mặt của tinh thể vào dung dịch. Do sự khuếch tán, các hạt phân bố đều khắp thể tích của dung môi. Sự hòa tan tiến tới bão hòa. Dung dịch chứa lượng chất tan lớn nhất ở nhiệt độ xác định và cân bằng với lượng chất tan dư được gọi là dung dịch bão hòa. Dung dịch siêu bão hòa là dung dịch có nồng độ cao hơn nồng độ của dung dịch bão hòa. Một dung dịch có nồng độ thấp hơn một dung dịch bão hòa được gọi là không bão hòa. Khả năng hòa tan của một chất trong một dung môi cụ thể được gọi là khả năng hòa tan. Về mặt số học, độ hòa tan của một chất bằng nồng độ của dung dịch bão hòa của chất đó. Độ hòa tan có thể được biểu thị theo cùng đơn vị với nồng độ, ví dụ, về lượng chất tan có trong 1 lít dung dịch bão hòa, mol / l, hoặc về khối lượng của chất tan trong 100 g dung dịch bão hòa. . Đơn vị đo độ tan là gam trên 100 g dung môi. Giá trị tương ứng được gọi là hệ số hòa tan. Độ tan phụ thuộc vào bản chất của chất tan và dung môi, nhiệt độ, áp suất và sự có mặt của các chất khác trong dung dịch. Ảnh hưởng đến độ hòa tan của bản chất của các thành phần Khả năng tan của các chất được quyết định bởi bản chất của lực tương tác giữa các phân tử của các thành phần của dung dịch X.1 họ2 : dung môi - dung môi (X1 -X1 ), solute - chất tan (X2 - X2 ), dung môi - chất tan (X1 - X2 ) (dấu chấm biểu thị liên kết phân tử). Khả năng hòa tan của các chất rất khác nhau. Các ví dụ cho thấy khả năng hòa tan của các muối khác nhau trong cùng một dung môi (nước) và độ hòa tan của cùng một chất (AgNO3 ) trong các dung môi khác nhau. Các chất có loại liên kết ion và các chất bao gồm các phân tử phân cực hòa tan tốt hơn trong các dung môi phân cực, chẳng hạn như nước, rượu. Các dung môi này được đặc trưng bởi hằng số điện môi cao. Độ hòa tan cao của các chất thường là do sự hình thành các liên kết liên phân tử, đặc biệt là hydro. Do đó, khả năng hòa tan lẫn nhau không giới hạn của nước và rượu được giải thích bằng sự hình thành liên kết hydro giữa các phân tử nước và rượu, và sự hòa tan của các tinh thể AgcI trong dung dịch nước amoniac được giải thích bằng sự hình thành liên kết cho-nhận hóa học của ion bạc với các phân tử amoniac (AgCI thực tế không hòa tan trong nước). Vì lý do tương tự, pyridin, một dung môi có điện môi thấp, thể hiện độ hòa tan rất cao. Vì độ hòa tan đặc trưng cho trạng thái cân bằng thực sự, ảnh hưởng của các điều kiện bên ngoài lên trạng thái này (áp suất, nhiệt độ) có thể được ước lượng một cách định tính bằng cách sử dụng nguyên lý Le Chatelier. Những đánh giá như vậy là cần thiết khi thực hành lặn sâu, khi làm việc trong các cửa hàng nóng, v.v. 15. Tính tan của chất khí trong chất lỏng. Định luật của Henry-Dalton và Sechenov Sự hòa tan của chất khí trong chất lỏng hầu như luôn kèm theo sự tỏa nhiệt. Do đó, độ hòa tan của các chất khí giảm khi nhiệt độ tăng theo nguyên lý Le Chatelier. Mô hình này thường được sử dụng để loại bỏ các khí hòa tan khỏi nước (ví dụ như CO02) bằng cách đun sôi. Đôi khi sự hòa tan của một chất khí đi kèm với sự hấp thụ nhiệt (ví dụ, sự hòa tan của các khí quý trong một số dung môi hữu cơ). Trong trường hợp này, tăng nhiệt độ làm tăng khả năng hòa tan của chất khí. Một chất khí không tan vô hạn trong chất lỏng. Ở một nồng độ khí X nhất định, một cân bằng được thiết lập:  Khi một chất khí tan trong một chất lỏng, thì thể tích của hệ sẽ giảm đi đáng kể. Do đó, sự gia tăng áp suất, theo nguyên lý của Le Chatelier, sẽ dẫn đến sự chuyển dịch cân bằng sang phải, tức là, làm tăng độ hòa tan của khí. Nếu chất khí tan ít trong một chất lỏng nhất định và áp suất thấp, thì độ tan của chất khí đó tỉ lệ thuận với áp suất của nó. Sự phụ thuộc này được thể hiện bằng định luật Henry (1803): Lượng khí bị hòa tan ở nhiệt độ xác định trong một thể tích chất lỏng nhất định ở trạng thái cân bằng tỷ lệ thuận với áp suất của chất khí. Định luật Henry có thể được viết dưới dạng sau: с (X) =Kr (X) ×P(NS) Nồng độ của khí trong dung dịch bão hòa là ở đâu, mol / l; P(NS) - áp suất khí X trên dung dịch, Pa; Kr (X) - Hằng số Henry đối với khí X, mol × l1 × Pa1 . Hằng số Henry phụ thuộc vào bản chất của khí, dung môi và nhiệt độ. Định luật Henry chỉ có hiệu lực đối với các dung dịch tương đối loãng, ở áp suất thấp và trong trường hợp không có tương tác hóa học giữa các phân tử của khí hòa tan và dung môi. Định luật Henry là một trường hợp đặc biệt của định luật Dalton nói chung. Nếu chúng ta đang nói về sự hòa tan không phải một chất ở thể khí mà là một hỗn hợp khí, thì sự hòa tan của mỗi thành phần tuân theo định luật Dalton: độ hòa tan của từng thành phần của hỗn hợp khí ở nhiệt độ không đổi tỷ lệ với áp suất riêng phần của thành phần ở trên chất lỏng và không phụ thuộc vào áp suất toàn phần của hỗn hợp và tính riêng của các thành phần khác. Nói cách khác, trong trường hợp hòa tan hỗn hợp khí trong chất lỏng, áp suất riêng phần p! thành phần này. Áp suất riêng phần của thành phần được hiểu là tỷ lệ giữa áp suất của thành phần so với áp suất toàn phần của hỗn hợp khí: Рi/ Rphổ thông Áp suất riêng phần của cấu kiện được tính theo công thức Nghiên cứu sự hòa tan của chất khí trong chất lỏng khi có chất điện ly, nhà sinh lý học người Nga I. M. Sechenov (1829-1905) đã thiết lập mô hình sau (định luật Sechenov): độ hòa tan của chất khí trong chất lỏng khi có mặt chất điện ly giảm; các chất khí được giải phóng. Рi = Pphổ thông × (Xi) p ở đâui - áp suất riêng phần của thành phần Xi; Рphổ thông áp suất toàn phần của hỗn hợp khí; x (Xi) là phần mol của thành phần thứ i. Nghiên cứu sự hòa tan của chất khí trong chất lỏng khi có chất điện ly, nhà sinh lý học người Nga I. M. Sechenov (1829-1905) đã thiết lập mô hình sau (định luật Sechenov): độ hòa tan của chất khí trong chất lỏng khi có mặt chất điện ly giảm; các chất khí được giải phóng. 16. Vai trò của sự khuếch tán trong các quá trình chuyển giao các chất trong hệ sinh vật Khuếch tán đóng một vai trò quan trọng trong hệ thống sinh học. Trước hết, sự di chuyển của các chất dinh dưỡng và các sản phẩm trao đổi chất trong dịch mô xảy ra thông qua sự khuếch tán. Ngoài ra, trong nhiều trường hợp, tốc độ của các quá trình hóa lý trong cơ thể sống được xác định bởi tốc độ khuếch tán của các chất phản ứng, vì sự khuếch tán của các chất phản ứng thường là giai đoạn chậm nhất của quá trình, trong khi các phản ứng sinh hóa liên quan đến enzym diễn ra rất nhanh. Mọi tế bào sống đều được bao bọc bởi một lớp màng có nhiệm vụ bảo vệ và điều hòa môi trường nội bào. Các chất đi qua màng bằng hai cơ chế chính: bằng cách khuếch tán thông thường (vận chuyển thụ động) và bằng cách vận chuyển hoạt hóa bằng năng lượng (vận chuyển tích cực). Lớp bên trong của màng bao gồm các chuỗi hydrocacbon. Do đó, nhiều phân tử trung tính nhỏ và phân tử HMS không phân cực có thể hòa tan trong lớp này và có thể đi qua màng bằng cách khuếch tán bình thường dọc theo một gradient nồng độ. Sự vận chuyển các chất như vậy được gọi là thụ động. Khuếch tán đóng một vai trò quan trọng trong quá trình oxy hóa máu trong phổi. Do sự phân nhánh lớn, bề mặt phế nang phổi lớn (~ 80 m2) nên oxy được hòa tan tích cực trong huyết tương và đi vào hồng cầu. Máu tĩnh mạch bị thiếu oxy - nồng độ oxy trong máu tĩnh mạch có xu hướng bằng không. Do đó, gradient nồng độ oxy giữa khí quyển và máu đi vào phổi cao, dẫn đến sự hấp thu tích cực (theo định luật Fick). Sự vận chuyển các chất từ vùng có nồng độ thấp hơn sang vùng có nồng độ cao hơn ngược chiều gradien gọi là vận chuyển tích cực. Quá trình như vậy không thể tiến hành một cách tự phát và đòi hỏi chi phí năng lượng. Nguồn năng lượng là phản ứng thủy phân ngoại sinh của một hợp chất vô cơ sinh học - adenosine triphosphate (ATP). Sự phân bố ổn định của nồng độ ion K trong và ngoài tế bào đạt được khi dòng ion K qua màng vào tế bào bằng dòng ion K ra khỏi tế bào do sự khuếch tán thụ động. Sự phân bố (cân bằng nội môi ion) cũng đạt được tương tự đối với các ion Na, chỉ có sự vận chuyển tích cực và sự khuếch tán thụ động bù trừ của các ion là hướng ngược lại với các dòng ion K tương ứng. Quá trình khuếch tán được sử dụng rộng rãi trong y học. Ví dụ, phương pháp lọc máu dựa trên tính chọn lọc của quá trình khuếch tán các chất có trọng lượng phân tử thấp qua màng bán thấm dọc theo gradient nồng độ được sử dụng trong thực hành lâm sàng để tạo ra bộ máy "thận nhân tạo". Các hạt của vòng tránh thai không đi qua màng bán thấm, vì vậy các chất lỏng sinh học (ví dụ huyết tương) có thể được lọc sạch bằng cách lọc máu khỏi các chất phân tử thấp có hại - "xỉ" (urê, axit uric, bilirubin, amin, ion K dư thừa) tích tụ trong các bệnh khác nhau. Trong quá trình thanh lọc, máu của bệnh nhân, được lấy từ tĩnh mạch, đi vào các khoang đặc biệt có màng bán thấm, qua đó NMS có thể khuếch tán và được loại bỏ khỏi huyết tương. Trong một số bệnh viêm, sự phá hủy protein xảy ra, và trong huyết tương, cùng với NMS, có những đoạn protein (peptit và polypeptit) cũng cần được loại bỏ. 17. Hạ nhiệt độ đông và tăng nhiệt độ sôi của các dung dịch Hệ quả trực tiếp của việc giảm áp suất hơi trong dung dịch là sự thay đổi điểm đóng băng ΔTз và điểm sôi của các dung dịch ΔTк so với giá trị của các đại lượng này đối với dung môi tinh khiết. Mối quan hệ giữa các đại lượng này cũng tuân theo định luật thứ hai của nhiệt động lực học. Điểm sôi của chất lỏng là nhiệt độ tại đó áp suất hơi của nó bằng với áp suất bên ngoài (ví dụ, ở 101,3 kPa, điểm sôi của nước là 100 ° C). Điểm đông đặc (kết tinh) của chất lỏng là nhiệt độ tại đó áp suất hơi trên chất lỏng bằng áp suất hơi trên pha rắn. Nếu chúng ta chỉ định điểm đông đặc và điểm sôi của dung dịch T3 và Tk, và các giá trị tương tự cho T ° của dung môi3 và T °к , sau đó chúng tôi nhận được: ΔTk = Tк - T °к > 0, ΔT3 = T °3 - T3 > KHAI THÁC. Tác động của việc tăng điểm sôi và giảm điểm đóng băng của các dung dịch có thể được giải thích một cách định tính bằng cách sử dụng nguyên lý Le Chatelier. Thật vậy, nếu trong một hệ cân bằng "lỏng - hơi" (ví dụ, H2О(NS) - H2О(g)), đưa vào một chất không bay hơi hòa tan, khi đó áp suất hơi của dung môi trên dung dịch sẽ giảm. Để bù đắp cho sự giảm áp suất hơi và đạt được trạng thái cân bằng trước đó, dung dịch phải được đun nóng đến nhiệt độ cao hơn (hơn 373 ° K), vì quá trình này là thu nhiệt. Để có một hệ cân bằng "pha rắn - lỏng", ví dụ H2О(t) > H2О(NS), ở 273°K. Nếu hòa tan một lượng nhất định chất không bay hơi (không tan trong pha rắn) vào pha lỏng thì nồng độ phân tử nước trong pha lỏng sẽ giảm. Theo nguyên tắc của Le Chatelier, một quá trình sẽ bắt đầu tăng lượng nước trong pha lỏng - quá trình tan băng. Để thiết lập trạng thái cân bằng mới, dung dịch phải được làm mát, nghĩa là nhiệt độ phải được hạ xuống, vì quá trình này tỏa nhiệt. Theo định luật Raoult đối với dung dịch loãng, sự giảm áp suất hơi tỷ lệ với nồng độ của dung dịch. Do đó, sự tăng nhiệt độ sôi và giảm điểm đông đặc của các dung dịch này sẽ tăng khi tăng nồng độ của chúng. Nghiên cứu sự đông đặc và sôi của các dung dịch, Raul nhận thấy: sự gia tăng nhiệt độ sôi ΔTк và hạ thấp điểm đóng băng ΔТ3 dung dịch loãng của các chất không điện li tỉ lệ thuận với nồng độ mol của dung dịch: ΔTк = Kэb(x), ΔT3 = Kз b(x), nơi b(NS) - nồng độ mol, mol / kg; Кз và Kэ - hệ số tương xứng, kg × K × mol1 , tương ứng được gọi là hằng số đo ebulliometric và cryometric. Ý nghĩa vật lý của các hằng số Kэ và Kз trở nên rõ ràng nếu chúng ta chấp nhận b(NS) = 1. Khi đó Kэ = ΔTк , và Kз = ΔTз . Nói cách khác, hằng số đo độ sôi bằng về mặt số với độ tăng điểm sôi của dung dịch một mol và hằng số đo độ lạnh bằng về mặt số với độ giảm điểm đóng băng của dung dịch một mol. Hằng số đo điện tích và đo độ lạnh chỉ phụ thuộc vào bản chất của dung môi và không phụ thuộc vào bản chất của chất tan (dung dịch lý tưởng). 18. Áp suất thẩm thấu Thẩm thấu là sự xâm nhập đơn phương chủ yếu của các phân tử dung môi (khuếch tán) qua màng bán thấm từ dung môi vào dung dịch hoặc từ dung dịch có nồng độ thấp hơn vào dung dịch có nồng độ cao hơn. Điều kiện cần thiết để xảy ra hiện tượng thẩm thấu là sự có mặt của một dung môi và một dung dịch hoặc hai dung dịch có nồng độ khác nhau, ngăn cách nhau bằng màng bán thấm. Theo quan điểm của nhiệt động lực học, động lực thẩm thấu là xu hướng cân bằng nồng độ của hệ thống, vì trong trường hợp này, entropy của hệ thống tăng lên, do hệ thống chuyển sang trạng thái kém trật tự hơn, năng lượng Gibbs của hệ thống giảm tương ứng và tiềm năng hóa học được cân bằng. Do đó, thẩm thấu là một quá trình tự phát. Một thí nghiệm đơn giản có thể dùng như một minh họa giải thích mối liên hệ giữa cơ chế thẩm thấu và sự thay đổi áp suất hơi trong dung dịch. Nếu đặt một cốc thủy tinh có dung môi nguyên chất và một cốc thủy tinh có chứa một số chất không bay hơi (mức chất lỏng trong các bình như nhau) trong một bình thủy tinh đậy kín thì sau một thời gian, mức chất lỏng trong bình là ly thứ nhất sẽ giảm, và mức độ của dung dịch trong ly thứ hai sẽ tăng lên. Trong trường hợp này, dung môi đi từ cốc thứ nhất sang cốc thứ hai, do (theo định luật Raoult) áp suất hơi của dung môi trong dung dịch thấp hơn so với dung môi nguyên chất. Do đó, không gian không khí giữa dung môi và dung dịch hoạt động như một màng bán thấm. Chúng ta hãy đổ đầy một bình có thành bán thấm bằng dung dịch nước của glucozơ và đặt nó vào một bình khác có nước sao cho mức chất lỏng trong các bình này trùng nhau. Kết quả của hiện tượng thẩm thấu, thể tích dung dịch trong bình thứ nhất tăng lên và mực chất lỏng trong bình này dâng lên dần dần. Điều này tạo ra một áp suất thủy tĩnh bổ sung ngăn cản sự thẩm thấu. Áp suất thủy tĩnh của cột chất lỏng ở trạng thái cân bằng thẩm thấu quyết định áp suất thẩm thấu của dung dịch. Áp suất thẩm thấu là giá trị được đo bằng áp suất thủy lực tối thiểu phải tác dụng lên dung dịch để ngăn quá trình thẩm thấu. Các định luật về áp suất thẩm thấu. Van't Hoff đã đề xuất một phương trình thực nghiệm để tính áp suất thẩm thấu của các dung dịch loãng của chất không điện ly: π = C(X)rt, trong đó π - áp suất thẩm thấu, kPa; С(X) - nồng độ mol, mol / l; R là hằng số khí chung bằng 8,31 kPa - l / (mol - K); T là nhiệt độ tuyệt đối, K. Mặc dù định luật van't Hoff được thiết lập trên cơ sở dữ liệu thực nghiệm, nó có thể được suy ra từ điều kiện cân bằng nhiệt động lực học tại ∆G = 0. Do đó, định luật này nên được coi là hệ quả của định luật thứ hai của nhiệt động lực học. Biểu thức ở dạng trên tương tự như phương trình Clapeyron-Mendeleev đối với khí lý tưởng, tuy nhiên, các phương trình này mô tả các quá trình khác nhau. 19. Vai trò của thẩm thấu và áp suất thẩm thấu trong hệ sinh vật Hiện tượng thẩm thấu đóng một vai trò quan trọng trong nhiều hệ thống hóa học và sinh học. Sự thẩm thấu điều chỉnh dòng chảy của nước vào tế bào và các cấu trúc gian bào. Tính đàn hồi của tế bào (turgor), đảm bảo tính đàn hồi của các mô và duy trì hình dạng nhất định của các cơ quan, là do áp suất thẩm thấu. Tế bào động vật và thực vật có vỏ hoặc lớp nguyên sinh chất bề mặt có các đặc tính của màng bán thấm. Khi các tế bào này được đặt trong các dung dịch có nồng độ khác nhau, hiện tượng thẩm thấu sẽ được quan sát thấy. Các dung dịch có cùng áp suất thẩm thấu được gọi là đẳng trương. Nếu hai dung dịch có áp suất thẩm thấu khác nhau, thì dung dịch có áp suất thẩm thấu cao là ưu trương đối với dung dịch thứ hai và dung dịch thứ hai là nhược trương đối với dung dịch thứ nhất. Khi các tế bào được đặt trong dung dịch đẳng trương, chúng vẫn giữ nguyên kích thước và hoạt động bình thường. Khi các tế bào được đặt trong một dung dịch nhược trương, nước từ một dung dịch bên ngoài ít đậm đặc hơn sẽ đi vào các tế bào, dẫn đến hiện tượng sưng tấy của chúng, sau đó dẫn đến vỡ màng và chảy ra ngoài các chất bên trong tế bào. Sự phá hủy tế bào này được gọi là ly giải, trong trường hợp hồng cầu quá trình này được gọi là quá trình tán huyết. Máu có thành phần tế bào thoát ra trong quá trình tán huyết được gọi là máu dầu bóng vì màu sắc của nó. Khi các tế bào được đặt trong một dung dịch ưu trương, nước sẽ rời khỏi các tế bào trong một dung dịch đậm đặc hơn, và các tế bào bị nhăn (làm khô) được quan sát thấy. Hiện tượng này được gọi là plasmolysis. Chất lỏng sinh học của con người (máu, bạch huyết, dịch mô) là dung dịch nước của các hợp chất phân tử thấp - NaCI, KCl, CaCl, các hợp chất cao phân tử - protein, polysacarit, axit nucleic và các nguyên tố hình thành - hồng cầu, bạch cầu, tiểu cầu. Tổng hành động của chúng xác định áp suất thẩm thấu của chất lỏng sinh học. Áp suất thẩm thấu của máu người ở 310 ° K (37 ° C) là 780 kPa (7,7 atm). Áp suất tương tự được tạo ra bởi dung dịch nước 0,9% NaCl (0,15 mol / l), do đó, là đẳng trương với máu (nước muối). Tuy nhiên, ngoài các ion Na và C1, còn có các ion khác trong máu, cũng như vòng tránh thai và các yếu tố hình thành. Vì vậy, đối với mục đích y tế, đúng hơn là sử dụng các dung dịch có chứa cùng thành phần và cùng số lượng với chất tạo thành máu. Các dung dịch này được dùng làm chất thay thế máu trong phẫu thuật. Cơ thể con người, ngoài áp suất thẩm thấu, được đặc trưng bởi sự ổn định (cân bằng nội môi) và các chỉ số hóa lý khác của máu, chẳng hạn như độ axit. Sự dao động cho phép của áp suất thẩm thấu của máu là rất nhỏ và ngay cả trong bệnh lý nặng cũng không vượt quá vài chục kPa. Trong các quy trình khác nhau, chỉ có các dung dịch đẳng trương mới có thể được tiêm vào máu người và động vật với số lượng lớn. Khi bị mất máu lớn (ví dụ, sau các cuộc phẫu thuật lớn, chấn thương), bệnh nhân được tiêm vài lít dung dịch đẳng trương để bù lại lượng dịch bị mất theo máu. Hiện tượng thẩm thấu được sử dụng rộng rãi trong thực hành y tế. Vì vậy, trong phẫu thuật, người ta sử dụng băng gạc ưu trương (gạc ngâm trong dung dịch NaCl 10% ưu trương), được tiêm vào vết thương có mủ. Theo quy luật thẩm thấu, dòng điện của dịch vết thương qua gạc hướng ra ngoài, do đó vết thương liên tục được làm sạch mủ, vi sinh vật và các sản phẩm thối rữa. 20. Mức độ phân ly (ion hóa). Sức mạnh của chất điện giải Chất điện ly gần như hoàn toàn phân ly thành ion (ion hóa) được gọi là chất điện ly mạnh và chất điện ly không bị ion hóa hoàn toàn được gọi là chất điện ly yếu. Trong dung dịch có các chất điện li yếu, cùng với các ion, có những phân tử không bị ion hóa. Chính bằng cách ion hóa không hoàn toàn, S. Arrhenius đã giải thích tại sao hệ số đẳng tích của dung dịch các chất điện ly yếu không bằng một số nguyên. Để mô tả một cách định lượng mức độ hoàn toàn của sự phân ly, khái niệm về mức độ phân ly (ion hóa) được đưa ra. Mức độ phân ly (ion hóa) của chất điện ly là tỷ số giữa số phân tử bị phân hủy thành ion trên tổng số phân tử của nó được đưa vào dung dịch. Nói cách khác, an là tỷ lệ các phân tử chất điện phân bị phân hủy thành các ion. Mức độ phân ly an được biểu thị bằng phần trăm hoặc phần nhỏ của một đơn vị: αн = Nн/ Np, trong đó N là số phân tử chất điện li bị phân huỷ thành ion; Np số phân tử chất điện li đưa vào dung dịch (bị hoà tan). Vì vậy, đối với C(CHXNUMXCOOH) = 0,1 mol / l, mức độ phân ly αн = 0,013 (hoặc 1,3%). Theo mức độ phân ly, chất điện ly được quy ước chia thành mạnh (αн > 30%) và yếu (αн <3%). Trong khoảng thời gian, chất điện phân được coi là có cường độ trung bình. Hầu hết tất cả các muối được coi là chất điện li mạnh. Trong số các axit và bazơ quan trọng nhất, H2SO4 , HCI, HBr, HI, HNO3 , NaOH, KOH, Ba (OH)2 . Chất điện ly yếu bao gồm hầu hết các axit hữu cơ, cũng như một số hợp chất vô cơ - H2S, HCN, N2Với3 , VÌ THẾ3 , HCl0, N2TRÊN3Trong3 ,Hg2CI2 , Fe (SCN)3 . An được xác định bằng thực nghiệm bằng cách đo độ lệch của các tính chất đối chiếu của các dung dịch điện li so với các phụ thuộc lý thuyết đối với các dung dịch lý tưởng. Ví dụ, hệ số đẳng áp i được xác định bằng phương pháp đông lạnh, sau đó tính mức độ phân ly. Sự sai lệch của hệ số đẳng tích i so với kiến thức số nguyên được giải thích cho chúng không phải do sự hiện diện của các phân tử không liên kết trong dung dịch, mà là do các lý do khác. Sự phân ly đi kèm với sự giải phóng hoặc hấp thụ nhiệt. Do đó, mức độ phân ly phải phụ thuộc vào nhiệt độ. Ảnh hưởng của nhiệt độ có thể được ước tính theo nguyên lý Le Chatelier. Nếu sự phân ly điện li xảy ra với sự hấp thụ nhiệt, thì khi nhiệt độ tăng, sự tăng lên, nếu với sự tỏa nhiệt, giảm đi. Mức độ phân ly điện ly bị ảnh hưởng bởi nồng độ của dung dịch. Khi dung dịch được pha loãng, mức độ phân ly tăng lên đáng kể. Về vấn đề này, sự phân loại được chỉ ra về độ mạnh của chất điện ly theo mức độ phân ly αн chỉ có giá trị đối với các dung dịch có nồng độ khoảng 0,1 mol / l. Nếu chúng ta coi sự phân ly điện phân là một quá trình thuận nghịch cân bằng, thì theo nguyên tắc Le Chatelier, việc pha loãng với nước làm tăng số lượng phân tử chưng cất, tức là mức độ phân ly tăng lên. Mức độ phân ly của các chất điện ly yếu cũng bị ảnh hưởng bởi sự thêm vào của các ion cùng tên. Do đó, việc đưa một chất điện ly yếu vào hệ thống cân bằng làm tăng nồng độ của các ion, theo nguyên lý Le Chatelier, dẫn đến sự chuyển dịch đáng kể của cân bằng phân ly sang trái, tức là làm giảm mức độ phân ly. . Do đó, việc thêm các ion cùng tên vào dung dịch chất điện ly yếu sẽ làm giảm mức độ phân ly của nó. 21. Hằng số phân ly. Định luật nhân giống của Ostwald. Lý thuyết về các dung dịch của chất điện li mạnh Về mặt định lượng, sự phân ly điện ly như một quá trình thuận nghịch cân bằng có thể được đặc trưng bởi một hằng số phân ly (ion hóa) được xác định bởi quy luật tác dụng của khối lượng. Nói một cách chính xác, định luật tác dụng của khối lượng có thể áp dụng cho các phản ứng thuận nghịch, tức là đối với các dung dịch của chất điện ly yếu. Ví dụ, sự phân ly của chất điện ly KtnAnm có thể được biểu diễn như một quá trình cân bằng: Ktn Anm × nKtm+ +mAn . Theo định luật tác dụng của khối lượng, hằng số cân bằng được viết như sau: КД = (Ktm+)n+ (Ann)m + (KtnAnm) ở đâu (Ktm+) và (Ann ) - nồng độ cân bằng mol của các ion chất điện ly; (KtnAnm) là nồng độ cân bằng mol của các phân tử chất điện li không phân ly; КД là hằng số cân bằng, được gọi là hằng số phân ly. Phương trình này chỉ đúng với các dung dịch loãng của chất điện li yếu. Khi áp dụng nó vào các dung dịch đậm đặc và các dung dịch có chất điện li mạnh, phải sửa đổi phương trình. Hằng số phân ly K càng lớnД , chất điện li càng nhiều. Ngược lại với mức độ phân ly KД chỉ phụ thuộc vào bản chất dung môi, chất điện li và nhiệt độ mà không phụ thuộc vào nồng độ của dung dịch. Do đó, cả hằng số và mức độ phân ly điện ly đều là các đặc điểm định lượng của sự phân ly. Đương nhiên, có một kết nối giữa họ. Các axit polybasic và các bazơ polyaxit phân ly theo từng bước. Ví dụ, sự phân ly của axit photphoric xảy ra theo ba bước:  Tương tự đối với các bazơ polyacid (ví dụ, Ca (OH)2) - phân ly diễn ra theo hai giai đoạn. Sự phân ly từng bước được đặc trưng bởi thực tế là sự phân hủy của chất điện phân ở mỗi giai đoạn tiếp theo xảy ra ở mức độ thấp hơn so với giai đoạn trước đó. Sự thay đổi hằng số phân ly như vậy có thể được giải thích bằng lực hút tĩnh điện trên cơ sở định luật Coulomb. Năng lượng ion hóa là cực tiểu khi một ion bị tách ra khỏi phân tử chất điện ly trung hòa. Sự tách rời của một ion ở mỗi bước phân ly tiếp theo đòi hỏi năng lượng ngày càng tăng, vì sự loại bỏ một ion xảy ra từ một hạt mà điện tích của nó trở nên lớn hơn ở các bước tiếp theo. Sự phân ly gần như hoàn toàn của các chất điện ly mạnh thành các ion, bất kể nồng độ của dung dịch chúng, được xác nhận bằng các phương pháp nghiên cứu vật lý và hóa lý. Như vậy, giá trị nhiệt trung hòa của tất cả các axit mạnh bằng bazơ mạnh trong dung dịch loãng gần như giống nhau. Không phân biệt tính chất axit và bazơ đều thu được cùng giá trị AH = 56,5 kJ/mol. Thực tế này là một bằng chứng rõ ràng về sự phân ly hoàn toàn của dung dịch axit và bazơ loãng. Trong mọi trường hợp, quá trình chung xảy ra trong quá trình trung hòa là sự kết hợp của các ion trong một mol 22. Lý thuyết về axit và bazơ Nhiều chất điện ly, đặc biệt là các hydroxit của các nguyên tố E khác nhau, thể hiện tính chất của axit hoặc bazơ. Sự phân ly của EON hydroxit có thể tiến hành theo hai loại: 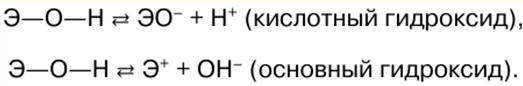 Khoảng cách có thể xảy ra dọc theo cả hai liên kết của nhóm E-O-N. Như đã biết, độ phân cực và độ bền của liên kết phụ thuộc vào sự khác biệt về độ âm điện của các nguyên tố, kích thước và điện tích hiệu dụng của các nguyên tử. Nếu năng lượng phá vỡ của liên kết O-H nhỏ hơn nhiều so với năng lượng phá vỡ của liên kết E-O, thì sự phân ly của hydroxit diễn ra tùy theo loại axit. Ngược lại, nếu năng lượng phá vỡ liên kết O-H lớn hơn nhiều so với năng lượng phá vỡ liên kết E-O, thì sự phân ly diễn ra theo kiểu chính. Trong hiđroxit của kim loại kiềm và kiềm thổ, cũng như các kim loại chuyển tiếp ở trạng thái oxi hóa thấp, độ bền của liên kết E-O tương đối thấp, oxi liên kết mạnh hơn với hiđro và sự phân ly E-O-H chủ yếu diễn ra theo kiểu cơ bản, tức là với sự loại bỏ hydroxit dione. Điều này là do các ion của các nguyên tố này có kích thước khá lớn và có điện tích hiệu dụng nhỏ, tức là chúng có khả năng phân cực yếu. Với sự gia tăng mức độ oxy hóa, hiệu ứng phân cực của nguyên tử E tăng lên (tăng điện tích riêng), oxy liên kết chặt chẽ hơn với nguyên tố E và sự phân ly của E-O-H chủ yếu diễn ra theo loại axit, tức là ion hydro bị tách ra. Cái sau được kết nối với sự phân phối lại mật độ electron ở nguyên tử oxy. Kết quả là liên kết EO trở nên mạnh hơn và liên kết OH trở nên yếu hơn. Hiện tại, không có định nghĩa rõ ràng nào về khái niệm axit và bazơ, những khái niệm này có thể được sử dụng như nhau để mô tả các tương tác axit-bazơ trong bất kỳ dung môi nào. Để mô tả đặc điểm của nhiều chất điện ly trong dung dịch nước, vẫn có thể sử dụng các khái niệm về axit và bazơ do Arrhenius đưa ra: 1) axit là một chất điện ly phân ly trong dung dịch để tạo thành các ion hydro H; 2) bazơ là chất điện ly phân ly trong dung dịch với sự tạo thành các ion OH hydroxit; 3) Chất lưỡng tính (hiđroxit lưỡng tính) là chất điện li phân li trong dung dịch tạo thành cả ion hiđro và ion hiđroxit. Chất lưỡng tính bao gồm các hydroxit của kẽm, nhôm, crom và các nguyên tố lưỡng tính khác, cũng như các axit amin, protein, axit nucleic. Việc áp dụng nguyên lý Le Chatelier cho chuỗi cân bằng axit-bazơ cho thấy rằng với sự gia tăng nồng độ của các ion OH hydroxit trong hệ thống, xác suất phân ly loại axit tăng lên. Sự gia tăng nồng độ của các ion hydro H+ trong hệ thống dẫn đến sự phân ly chiếm ưu thế theo loại chính. Điều này có nghĩa là trong môi trường axit, ampholit thể hiện tính chất cơ bản và trong môi trường kiềm, nó thể hiện tính chất axit. Ví dụ, kẽm hydroxit hoạt động như một bazơ khi tương tác với axit: Zn (OH)2 + 2HCI - ZnCI2 + 2 giờ2O, và khi tương tác với kiềm - như một axit: Zn (OH)2+ 2NaOH → Na2[Zn(OH)4]. 23. Hệ thống đệm máu. Huyết tương Hệ thống đệm có tầm quan trọng lớn trong việc duy trì sự cân bằng axit-bazơ của sinh vật. Chất lỏng nội bào và ngoại bào của tất cả các sinh vật sống được đặc trưng bởi một giá trị pH không đổi, được duy trì với sự trợ giúp của hệ thống đệm. Giá trị pH của hầu hết các chất lỏng nội bào nằm trong khoảng từ 6,8 đến 7,8. Sự cân bằng axit-bazơ của cân bằng KO trong máu người được cung cấp bởi hệ thống đệm hydro-cacbonat, photphat và protein. Giá trị pH bình thường của huyết tương là 7,40 ± 0 05. Điều này tương ứng với phạm vi giá trị axit hoạt tính từ 3,7 đến 4,0x108 mol / l. Vì có nhiều chất điện giải khác nhau trong máu (HC03 , H2CO3 , N2RO4 , NRO42 ), protein, axit amin, có nghĩa là chúng phân ly đến mức độ hoạt động của a (H +) nằm trong phạm vi được chỉ định. Do hàm lượng các chất vô cơ và hữu cơ trong huyết tương và tế bào máu không giống nhau, nên xem xét các thành phần máu này một cách riêng biệt. huyết tương Hệ thống đệm HCO3 / N2Với3 được tạo thành từ axit cacbonic2Với3 và bazơ liên hợp HCO3 . Nó là hệ thống đệm quan trọng nhất trong máu. Một trong những thành phần là axit cacbonic H2Với3 - được hình thành do sự tương tác của CO hòa tan trong huyết tương2 với nước: Với2 (p) + H2Anh N2Với3. ở đâu CO2 (p) - nồng độ CO hòa tan2 . Hằng số cân bằng của phản ứng này là: K = [N2Với3] / [CO2] Giữa CO2 trong các phế nang và đệm hydro-cacbonat trong huyết tương chảy qua các mao mạch của phổi, một chuỗi cân bằng được thiết lập. Hệ thống đệm hydro cacbonat hoạt động như một chất đệm sinh lý hiệu quả gần pH 7,4. Khi axit xâm nhập vào máu - người cho H+ trạng thái cân bằng trong chuỗi theo nguyên tắc Le Chatelier dịch chuyển sang trái do các ion HCO3 liên kết ion H thành phân tử H2Với3 . Đồng thời, nồng độ H2Với3 tăng, và nồng độ của các ion HCO3 đi xuống. Tăng nồng độ H2Với3 dẫn đến sự chuyển dịch của trạng thái cân bằng sang trái, (nguyên lý của Le Chatelier). Nó gây ra sự thối rữa2Với3 và sự gia tăng nồng độ CO2 tan trong huyết tương. Kết quả là, cân bằng dịch chuyển sang trái và áp suất của CO tăng.2 trong phổi. CO dư thừa2 đào thải ra khỏi cơ thể. Kết quả là, hệ thống hydro-cacbonat của máu nhanh chóng đạt trạng thái cân bằng với CO2 trong các phế nang và duy trì hiệu quả sự ổn định của độ pH của huyết tương. 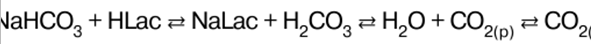 Do đó, giá trị pH máu bình thường được duy trì với sự thay đổi pH rõ rệt do nhiễm toan. Trong không gian kín, họ thường bị ngạt thở (thiếu oxy), tăng nhịp thở. Tuy nhiên, ngạt thở không liên quan nhiều đến việc thiếu oxy mà là do thừa CO2. CO dư thừa2 trong khí quyển, theo định luật Henry, dẫn đến sự hòa tan thêm CO2 trong máu. Và điều này dẫn đến giảm độ pH trong máu, tức là nhiễm toan. Hệ thống đệm hydro-cacbonat phản ứng nhanh nhất với sự thay đổi của pH máu. Dung lượng đệm axit của nó là Vк \ u40d XNUMX mmol / l huyết tương và dung lượng đệm cho kiềm ít hơn nhiều và xấp xỉ bằng Vщ = 1-2 mmol / l huyết tương. 24. Phản ứng trung hòa Phản ứng trung hòa được gọi là phản ứng trao đổi tương tác của axit và bazơ, do đó muối và nước được tạo thành. Xem xét các loại phản ứng trung hòa khác nhau. 1. Trung hòa một bazơ mạnh bằng một axit mạnh: KOH + HNO3 - KHÔNG3 + H2O. Phương trình ion phân tử cho một phản ứng như vậy H+ + OH → N2O và giá trị âm của năng lượng Gibbs ΔG ° cho thấy rằng thực tế cân bằng chuyển dịch theo hướng hình thành nước. Một trường hợp phổ biến của phản ứng trung hòa là tương tác của axit và bazơ khác nhau về độ mạnh (mức độ phân ly). Các phản ứng này không đi đến hoàn thành do phản ứng ngược lại của quá trình thủy phân muối. 2. Trung hòa một axit yếu với một bazơ mạnh:  hoặc ở dạng phân tử:  Trong trường hợp này, phản ứng trung hòa là thuận nghịch. Phản ứng trung hòa một bazơ yếu với một axit mạnh cũng là phản ứng thuận nghịch:  hoặc ở dạng phân tử: 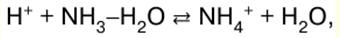 và cả - một bazơ yếu với một axit yếu: 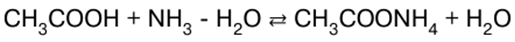 hoặc ở dạng phân tử:  Trong các hệ thống này, cân bằng chuyển dịch mạnh sang phải, vì nước là chất điện ly yếu hơn nhiều so với axit hydrocyanic, amoniac và axit axetic. Phản ứng trung hòa là cơ sở của phương pháp trung hòa. Phương pháp này được sử dụng trong các phòng thí nghiệm lâm sàng để xác định độ axit của dịch vị, khả năng đệm của huyết tương. Trong dược học, nó được sử dụng để phân tích định lượng các axit vô cơ (hydrochloric, sulfuric, boric) và các axit hữu cơ (acetic, benzoic, tartaric, citric, salicylic). Trong nghiên cứu dược phẩm sinh học, pKa của axit và pKa của bazơ được xác định bằng cách trung hòa, vì giá trị của những giá trị này có thể dự đoán khả năng của thuốc đi qua màng sinh học. Chuẩn độ axit-bazơ được sử dụng để xác định pKа axit amin và pKа phân ly các nhóm trong prôtêin. Các đường cong chuẩn độ protein thu được ở hai nhiệt độ khác nhau có thể được sử dụng để xác định số lượng cacboxyl, imidazole và các nhóm khác. Chuẩn độ axit amin và protein giúp xác định điểm đẳng điện của chúng. Thủy phân là sự phân hủy một chất bởi nước. Các hợp chất hóa học thuộc nhiều lớp khác nhau có thể bị thủy phân: protein, chất béo, cacbohydrat, este, muối, ... Trong hóa học vô cơ, chúng thường gặp nhất là sự thủy phân của muối. 25. Sự thủy phân muối Thủy phân muối - Đây là sự tương tác của muối với các phân tử nước, dẫn đến sự hình thành các hợp chất phân ly thấp. Quá trình thủy phân bao gồm sự chuyển đổi của một proton từ một phân tử nước thành một ion nhất định (CO32 + HOH * HCO3+ OH ) hoặc từ một ion nhất định, bao gồm từ cation kim loại ngậm nước, đến phân tử nước. Tùy thuộc vào bản chất của muối, nước đóng vai trò là axit hoặc bazơ, và muối tương ứng là bazơ liên hợp hoặc axit liên hợp. Có thể có bốn dạng thủy phân tùy thuộc vào loại muối. 1. Muối tạo bởi một axit mạnh và một bazơ yếu:  2. Muối tạo bởi một bazơ mạnh và một axit yếu: CH3COONa + HOH → CH3COOH + NaOH. 3. Muối tạo thành bởi một axit yếu và một bazơ yếu. Amoni xianua bị thủy phân bằng phản ứng: 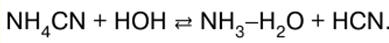 4. Muối tạo thành bởi một axit mạnh và một bazơ mạnh. NaCl, KNO3 không bị thủy phân. Cơ chế của quá trình thủy phân muối bao gồm tương tác phân cực của các ion muối với lớp vỏ thủy phân của chúng. Tương tác này càng mạnh thì sự thủy phân càng mạnh. Tất cả các trường hợp đã xét về sự thủy phân liên quan đến muối tạo thành bởi một gốc axit và một axit một bazơ. Muối của axit đa bazơ và bazơ đa axit bị thủy phân từng bước, tạo thành muối axit và muối bazơ. Về mặt định lượng, sự thủy phân ở trạng thái cân bằng CO được đặc trưng bởi mức độ thủy phân và hằng số thủy phân. Mức độ thủy phân được đo bằng tỷ số giữa lượng chất bị thủy phân với tổng lượng chất tan. Mức độ thủy phân phụ thuộc vào bản chất của muối, nồng độ và nhiệt độ. Theo quy luật tác dụng của khối lượng, mức độ thủy phân tăng khi pha loãng dung dịch. Vì vậy, ở nồng độ Na2CO3 0,001 mol / l, mức độ thủy phân là 34%. Trong trường hợp chung, các quy định sau đây là đúng. 1. Sự thủy phân của muối nên tăng khi nhiệt độ tăng và độ loãng của dung dịch. 2. Với sự thủy phân thuận nghịch, theo nguyên tắc Le Chatelier, quá trình này nên được ngăn chặn bằng cách axit hóa (nếu muối này được tạo thành bởi một axit mạnh và một bazơ yếu, các ion H tích tụ) hoặc bằng cách kiềm hóa (nếu muối được tạo thành bởi một axit yếu và một bazơ mạnh, các ion OH tích lũy). 3. Sự thủy phân của các muối, kết quả là các sản phẩm kém hòa tan hoặc khí được tạo thành, chúng bị loại bỏ khỏi quả cầu phản ứng (nguyên tắc chuyển dịch cân bằng), là không thể đảo ngược. Ví dụ: thủy phân Pb (SO4)2 tiến hành hoàn toàn do sự tạo thành kết tủa PbO2: Pb (VẬY4)2 + 2 giờ2O→PbO2 + 2 giờ2SO4. Sự thủy phân là đặc trưng của nhiều lớp hợp chất vô cơ và hữu cơ. Quá trình thủy phân các hợp chất vô cơ rất quan trọng để đánh giá độc tính của chúng. Thủy phân các hợp chất hữu cơ được sử dụng để thu được các sản phẩm có giá trị từ gỗ, chất béo, este và những thứ khác, nhưng thủy phân đóng một vai trò đặc biệt quan trọng đối với sự sống của các sinh vật sống. 26. Phản ứng tạo kết tủa và hòa tan Các phản ứng trao đổi xảy ra trong dung dịch chất điện li bao gồm các phản ứng tạo kết tủa và phản ứng hòa tan. Phản ứng kết tủa có kèm theo kết tủa. Các phản ứng kèm theo sự hoà tan kết tủa được gọi là phản ứng hoà tan. Các hệ thống bao gồm lắng đọng một chất điện phân ít hòa tan và một dung dịch bão hòa bên trên nó được sử dụng rộng rãi. Trong các hệ thống như vậy, cân bằng động được thiết lập giữa dung dịch bão hòa và kết tủa. Do độ tan thấp nên nồng độ của chất điện li ít tan trong dung dịch rất thấp nên có thể coi là chất điện li hoàn toàn trong dung dịch. Nói cách khác, cân bằng động trong dung dịch bão hòa được thiết lập giữa pha rắn của chất và các ion đã đi vào dung dịch. Ví dụ, trong dung dịch bão hòa AgCl, cân bằng sau đây xảy ra: AgCl (T) → Ag+(P) +Cl(R). Nồng độ của pha rắn AgCl là một giá trị không đổi được loại trừ khỏi biểu thức của hằng số cân bằng. Kết quả là hằng số cân bằng chỉ được xác định bởi tích của nồng độ ion trong dung dịch và được gọi là hằng số hay tích số tan. Trong trường hợp tổng quát, đối với chất điện ly Ktn Anm, hằng số hòa tan được xác định bằng tích phân số của nồng độ ion: Кpr= [Ktm+ ]n[Mộtn]m Giá trị này đặc trưng cho độ tan của chất điện ly ở nhiệt độ không đổi trong điều kiện không có chất lạ. K hằng sốpr không có nghĩa là hằng số của nồng độ của các ion riêng lẻ trong dung dịch. Do đó, có thể tăng nồng độ của ion Ag trong dung dịch bão hòa của AgCl bằng cách thêm, ví dụ, AgNO3 , trong khi trạng thái cân bằng theo nguyên lý Le Chatelier sẽ dịch chuyển sang trái dẫn đến tăng tốc độ lắng đọng ion. Sau một thời gian, tốc độ hòa tan của AgCl và sự kết tủa của các ion Ag và Cl sẽ trở nên bằng nhau. Như trước đây, trạng thái cân bằng mới được thiết lập sẽ được đặc trưng bởi giá trị Kpr(AgCl), nhưng nồng độ cân bằng của các ion Ag và Cl sẽ thay đổi. Do đó, dựa trên Kpr Có thể dự đoán sự hình thành và hoà tan các chất điện li kết tủa dựa trên hai quy tắc. 1. Chất điện ly kết tủa khi tích phân vị của nồng độ các ion của nó trong dung dịch lớn hơn hằng số hòa tan. 2. Kết tủa sau điện phân tan khi tích phân cực của nồng độ các ion thành phần của nó trong dung dịch nhỏ hơn hằng số hòa tan. Phản ứng kết tủa là cơ sở của phương pháp kết tủa được sử dụng trong phân tích định lượng dược phẩm. Phương pháp kết tủa được sử dụng trong phân tích lâm sàng clorua trong nước tiểu, dịch dạ dày, máu, trong thực hành vệ sinh và vệ sinh - trong phân tích nước uống. Các nhà khoa học tin rằng khả năng hòa tan khác nhau của các hợp chất tự nhiên của các nguyên tố trong nước có ảnh hưởng lớn đến hàm lượng của chúng trong cơ thể sống. Có mối quan hệ chặt chẽ giữa độ tan của các hợp chất trong nước và tác dụng độc của ion của một số nguyên tố. Ví dụ, sự ra đời của Al3 + vào cơ thể do tạo nhôm photphat kém tan AlPO4. 27. Các phản ứng oxi hóa khử Một trong những khái niệm cơ bản của hóa học vô cơ là khái niệm về trạng thái oxi hóa (CO). Trạng thái oxi hóa của một nguyên tố trong hợp chất là điện tích chính thức của nguyên tử nguyên tố đó, được tính từ giả thiết rằng các electron hóa trị chuyển cho nguyên tử có độ âm điện tương đối lớn hơn (REO) và tất cả các liên kết trong phân tử hợp chất đều là ion. Trạng thái oxy hóa của nguyên tố E được biểu thị ở trên cùng phía trên ký hiệu nguyên tố bằng dấu "+" hoặc "-" trước số. Mức độ oxy hóa của các ion thực sự tồn tại trong dung dịch hoặc tinh thể trùng với số điện tích của chúng và được biểu thị tương tự bằng dấu "+" hoặc "-" sau số, ví dụ: Cl, Ca2+. Phương pháp Stock cũng được dùng để chỉ mức độ oxi hóa bằng chữ số La Mã sau ký hiệu của nguyên tố: Mn (VII), Fe (III). Câu hỏi về dấu của trạng thái oxi hóa của các nguyên tử trong phân tử được giải quyết trên cơ sở so sánh độ âm điện của các nguyên tử liên kết với nhau tạo thành phân tử. Trong trường hợp này, một nguyên tử có độ âm điện thấp hơn có trạng thái oxy hóa dương và với độ âm điện cao hơn - âm. Cần lưu ý rằng trạng thái oxy hóa không thể được xác định với hóa trị của nguyên tố. Hóa trị, được định nghĩa là số lượng liên kết hóa học mà một nguyên tử nhất định được kết nối với các nguyên tử khác, không thể bằng XNUMX và không có dấu "+" hoặc "-". Trạng thái oxy hóa có thể có cả giá trị dương và âm, cũng như giá trị bằng XNUMX và thậm chí là phân số. Chẳng hạn, trong phân tử CO2 trạng thái oxi hóa của C là +4, và trong phân tử CH4 trạng thái oxi hóa của C là 4. Hóa trị của cacbon4 a trong cả hai hợp chất là IV. Mặc dù có những nhược điểm trên, việc sử dụng khái niệm mức độ oxi hóa rất thuận tiện trong việc phân loại các hợp chất hóa học và lập phương trình phản ứng oxi hóa khử. Khi một nguyên tố bị oxi hóa thì trạng thái oxi hóa tăng, hay nói cách khác chất khử trong quá trình phản ứng sẽ tăng trạng thái oxi hóa. Ngược lại, khi nguyên tố bị khử thì trạng thái oxi hóa giảm, tức là trong phản ứng, chất oxi hóa giảm trạng thái oxi hóa. Như vậy, có thể đưa ra công thức cấu tạo của phản ứng oxi hóa khử như sau: phản ứng oxi hóa khử là phản ứng xảy ra với sự thay đổi trạng thái oxi hóa của nguyên tử các nguyên tố tạo nên chất tham gia phản ứng. 28. Chất oxi hóa và chất khử Để dự đoán sản phẩm và chiều của phản ứng oxi hóa khử, cần nhớ rằng chất oxi hóa điển hình là những chất đơn giản mà nguyên tử của chúng có EER lớn> 3,0 (nguyên tố thuộc nhóm VIA và VIIA). Trong số này, chất oxi hóa mạnh nhất là flo (OEO = 4,0), oxi (OEO = 3,0), clo (OEO = 3,5). Các chất oxy hóa quan trọng bao gồm PbO2 , KMnO4 , Ca (SO4)2 , ĐẾN2Cr2O7 , HClO, HClO3, KSIO4, NaBio3, H2SO4(chấm dứt), HNOXNUMX3 (cuối) Na2O2 , (NH4)2S2O8 , KSIO3 , H2O2 và các chất khác có chứa nguyên tử CO cao hơn hoặc cao hơn. Chất khử đặc trưng gồm những chất đơn giản mà nguyên tử của chúng có EER nhỏ <1,5 (kim loại nhóm IA, IIA và một số kim loại khác). Các chất khử quan trọng bao gồm H2S,NH3, HI, KI, SnCl2 , FeSO4 ,C,H2 ,CO,H2SO3 , cr2(VÌ THẾ4)3 , CuCl, Na2S2O3 và các chất khác có chứa nguyên tử CO thấp. Các chất chứa nguyên tử ở trạng thái oxi hóa cực đại và cực tiểu tương ứng chỉ có thể là chất oxi hóa, ví dụ K2SG2O7 , KMPO4 , PbO2 , HClO4 hoặc chỉ các chất khử, chẳng hạn như NH3 , H2XIN CHÀO. Chất có chứa nguyên tử ở trạng thái oxi hóa trung gian có khả năng vừa nâng vừa hạ trạng thái oxi hóa, nghĩa là chúng có thể vừa là chất khử (dưới tác dụng của chất oxi hóa mạnh hơn chúng) vừa là chất oxi hóa (dưới tác dụng của một chất hơn hoạt động hơn chúng, chất khử). Những chất như vậy thể hiện tính lưỡng tính oxi hóa khử. Khi lập phương trình của các phản ứng oxi hóa khử có thể sử dụng hai phương pháp: phương pháp cân bằng electron và phương pháp ion-electron (phương pháp nửa phản ứng). Một ý tưởng đúng đắn hơn về các quá trình oxi hóa khử trong dung dịch được đưa ra bằng phương pháp ion-electron. Với sự trợ giúp của phương pháp này, những thay đổi được dự đoán rằng các ion và phân tử thực sự tồn tại trong dung dịch sẽ trải qua. Ngoài việc dự đoán các sản phẩm phản ứng, các phương trình bán phản ứng ion cần thiết để hiểu các quá trình oxy hóa khử xảy ra trong quá trình điện phân và trong các tế bào mạ. Phương pháp này phản ánh vai trò của môi trường như một bên tham gia vào quá trình. Và cuối cùng, khi sử dụng phương pháp này, không cần thiết phải biết trước tất cả các chất tạo thành, vì nhiều chất trong số đó thu được bằng cách lập phương trình phản ứng oxi hóa khử. Cần lưu ý rằng mặc dù các nửa phản ứng phản ánh các quá trình thực xảy ra trong các phản ứng oxy hóa khử, chúng không thể được xác định với các giai đoạn thực sự (cơ chế) của phản ứng oxy hóa khử. Nhiều yếu tố ảnh hưởng đến bản chất và hướng của phản ứng oxi hóa khử: bản chất của chất phản ứng, phản ứng của môi trường, nồng độ, nhiệt độ, chất xúc tác. Cần lưu ý rằng một giá trị âm không phải lúc nào cũng dẫn đến quyết định rõ ràng về quá trình thực tế của phản ứng theo một hướng nhất định, vì cần phải tính đến yếu tố động học. 29. Ý nghĩa sinh học của các quá trình oxy hóa khử Phản ứng oxy hóa khử là quá trình hóa học kèm theo sự chuyển các electron từ phân tử hoặc ion này sang phân tử hoặc ion khác. Trong phản ứng oxi hóa khử, xảy ra hai quá trình tương hỗ với nhau: quá trình oxi hóa và quá trình khử. Quá trình oxy hóa là quá trình mất electron. Phục hồi là quá trình thêm electron. Những chất mà nguyên tử hoặc ion của nó nhường electron được gọi là chất khử. Những chất mà nguyên tử hoặc ion của chúng thêm electron (hoặc kéo một cặp electron chung cho chính chúng) được gọi là chất oxi hóa. Trong phản ứng của kẽm với CuSO4 Cu2 + thêm electron: Si2+ + 2e - - Sĩ0 . Nguyên tử kẽm tặng electron: Zn0 -Zn2 + 2e -. Theo đó, CuSO4 - chất oxi hóa, Zn - chất khử. Các quá trình quan trọng trong cơ thể động vật là phản ứng oxy hóa enzym của các chất nền: carbohydrate, chất béo, axit amin. Kết quả của các quá trình này, các sinh vật nhận được một lượng lớn năng lượng. Khoảng 90% tổng nhu cầu năng lượng của một nam giới trưởng thành được cung cấp bởi năng lượng được tạo ra trong các mô trong quá trình oxy hóa carbohydrate và chất béo. Phần năng lượng còn lại - ~10% được cung cấp bởi quá trình oxy hóa phân hủy axit amin. Quá trình oxy hóa sinh học tiến hành thông qua các cơ chế phức tạp với sự tham gia của một số lượng lớn các enzym. Trong ti thể, quá trình oxy hóa xảy ra do sự chuyển điện tử từ chất nền hữu cơ. Là chất mang điện tử, chuỗi hô hấp của ti thể bao gồm các protein khác nhau chứa các nhóm chức năng khác nhau được thiết kế để mang điện tử. Khi chúng di chuyển dọc theo chuỗi từ vật trung gian này sang vật trung gian khác, các electron mất năng lượng tự do. Cứ một cặp electron chuyển qua chuỗi hô hấp thành oxy thì có 3 phân tử ATP được tổng hợp. Năng lượng tự do giải phóng trong quá trình chuyển 2 electron thành oxi là 220 kJ / mol. Quá trình tổng hợp 1 phân tử ATP ở điều kiện tiêu chuẩn tiêu tốn 30,5 kJ. Từ đó rõ ràng là một phần khá đáng kể của năng lượng tự do được giải phóng trong quá trình chuyển một cặp điện tử được lưu trữ trong các phân tử ATP. Từ những dữ liệu này, vai trò của sự chuyển điện tử nhiều tầng từ chất khử ban đầu thành oxy cũng trở nên rõ ràng. Năng lượng lớn (220 kJ) được giải phóng trong quá trình chuyển một cặp electron thành oxy được chia thành một số phần tương ứng với các giai đoạn oxy hóa riêng lẻ. Ở ba giai đoạn như vậy, lượng năng lượng được giải phóng xấp xỉ với năng lượng cần thiết cho quá trình tổng hợp 1 phân tử ATP. Các phản ứng oxi hóa khử làm cơ sở cho các phương pháp đo oxy hóa, được sử dụng trong phân tích lâm sàng để xác định các ion Ca, axit uric, các enzym catalase và peroxidase, đường trong máu, và trong phân tích vệ sinh và vệ sinh để xác định khả năng oxy hóa của nước, hàm lượng clo hoạt tính trong thuốc tẩy, clo dư trong nước sinh hoạt và nước uống 30. Liên kết hóa học và đặc điểm thí nghiệm của nó Sự phát triển của một mô hình nguyên tử hiện đại và dự đoán các tính chất của các nguyên tử riêng lẻ trên cơ sở của nó là một thành tựu rất quan trọng của cơ học lượng tử. Tuy nhiên, các nguyên tử bị cô lập hiếm khi được tìm thấy trong điều kiện trên mặt đất. Các cơ thể vô tri vô giác và sống xung quanh chúng ta bao gồm nhiều loại phân tử. A. M. Butlerov (1828-1886) đã sáng tạo ra lý thuyết về cấu trúc hóa học của các chất hữu cơ (1861). Kể từ thời điểm đó, các khái niệm "hóa trị" và "liên kết hóa học" dần dần bắt đầu đi vào hóa học. Hiệu lực là khả năng của một nguyên tử để gắn một số lượng nhất định các nguyên tử khác để tạo thành một phân tử. Hiệu lực được biểu thị bằng dấu gạch ngang bên cạnh biểu tượng phần tử. Hydro (H) là hóa trị một, oxy (0= ) là hóa trị hai. Số vạch hóa trị xác định số liên kết hóa học mà một nguyên tử nhất định có thể hình thành với các nguyên tử khác. Liên kết hóa học là một tập hợp các tương tác giữa các electron và hạt nhân, dẫn đến sự kết hợp của các nguyên tử thành một phân tử. Các tính chất của liên kết hóa học được nghiên cứu bằng nhiều phương pháp khác nhau. Với sự trợ giúp của các phương pháp hóa học, số lượng liên kết của các nguyên tử (hóa trị) và khả năng phản ứng của chúng được xác định. Sử dụng phương pháp vật lý, độ dài, độ bền, định hướng và độ phân cực của các liên kết hóa học được xác định. Độ dài liên kết hóa học rс gọi là giá trị đo bằng khoảng cách giữa các hạt nhân của các nguyên tử liên kết. Là một đơn vị đo độ dài liên kết hóa học gс thuận tiện để sử dụng picometer (chiều): 1 giờ chiều = 1012 m Độ bền liên kết hóa học Eс - giá trị đo bằng entanpi ΔЕс hình thành kết nối. Là một đơn vị đo độ bền liên kết hóa học Eс kJ / mol đã dùng. Định hướng liên kết hóa học aс - giá trị đo bằng góc giữa hướng của các liên kết của một nguyên tử nhất định với các nguyên tử lân cận của phân tử. Góc ac được gọi là góc hóa trị. Đơn vị góc liên kết aс - bằng cấp. Độ phân cực của liên kết hóa học μс - giá trị đo bằng mômen điện của mối nối này. Momen điện của hai điện tích +q và ־q, bằng nhau về giá trị tuyệt đối và ngược dấu, bằng μ = qr, trong đó r là khoảng cách giữa các điện tích. Hai điện tích này tạo thành một lưỡng cực điện. Một liên kết hóa học phân cực khi 2 nguyên tử có độ âm điện (EEO) khác nhau liên kết. Kết quả là, một điện tích âm dư thừa δ phát sinh trên một nguyên tử có EER lớn, và một điện tích dương dư thừa +δ phát sinh trên một nguyên tử khác có EER nhỏ hơn. Độ phân cực của liên kết được tính theo công thức: μс = rс. Là một đơn vị đo độ phân cực của liên kết hóa học, thật thuận tiện khi sử dụng đơn vị Debye ngoài hệ thống (D) - 1 D = 3,3 x 1030 C/m. Độ phân cực của liên kết O-H trong phân tử nước là μông = 1,5D. Nghiên cứu về liên kết hóa học cho thấy trong hầu hết các trường hợp, độ dài, độ bền, định hướng, độ phân cực của cùng một liên kết hóa học trong các hợp chất khác nhau có giá trị xấp xỉ nhau. Do đó, tương tác dẫn đến sự hình thành liên kết nhất định giữa các nguyên tử có cùng bản chất trong các phân tử khác nhau. Các lý thuyết cơ học lượng tử về liên kết hóa học đưa ra lời giải thích cho thực tế này. 31. Liên kết hiđro. Liên kết hydro giữa các phân tử và nội phân tử Liên kết hóa học trong phân tử thường rất bền, năng lượng của chúng nằm trong khoảng 100-150 kJ / mol. Ngoài ra, còn có cái gọi là liên kết hydro, cường độ của chúng là 10-40 kJ / mol. Chiều dài của các trái phiếu này tương ứng là 270-230 pm. Liên kết hiđro giữa các nguyên tử EА và EВ được gọi là tương tác được thực hiện bởi một nguyên tử hydro liên kết với EА hoặc EВ liên kết hóa học. Ảnh của liên kết hiđro trong trường hợp tổng quát có dạng: ЭА-N ... Eв.. Rõ ràng, liên kết hydro là ba tâm, vì 3 nguyên tử tham gia vào quá trình hình thành của nó. Để xảy ra liên kết như vậy, điều cần thiết là các nguyên tử EА và EВ có độ âm điện lớn. Đây là nguyên tử của các nguyên tố âm nhất: nitơ (REO = 3,0), oxy (REO = 3,5), flo (REO = 4,0) và clo (REO = 3,0). Liên kết hydro được hình thành do sự kết hợp của ls-AO hydro và hai nguyên tử 2pAO EА và EВ; 2rorbitals được định hướng dọc theo một đường thẳng. Do đó, liên kết hydro là tuyến tính. Liên kết hydro được gọi là: 1) nội phân tử, nếu các nguyên tử EА và EВ , được nối với nhau bằng liên kết này, thuộc cùng một phân tử; 2) liên phân tử, nếu nguyên tử EА và EВ nằm trong các phân tử khác nhau. Các liên kết hydro nội phân tử đóng một vai trò sinh học quan trọng, vì chúng quyết định, ví dụ, cấu trúc xoắn ốc của các phân tử protein cao phân tử. Trong protein, đây là các liên kết N-H...O giữa các gốc axit amin. Quan trọng không kém là các liên kết hydro liên phân tử. Với sự giúp đỡ của họ, các chuỗi axit nucleic được kết nối với nhau, tạo thành chuỗi xoắn kép. Có hai loại liên kết giữa các bazơ nucleic - NHN và N-H-O. Động năng trung bình của chuyển động nhiệt của các phân tử có bậc 3 / 2RT. Ở nhiệt độ cơ thể con người là 37 ° C (310 ° K), đây là khoảng 4 kJ / mol. Độ bền của các liên kết hydro nằm trong khoảng 10-40 kJ / mol, do đó chúng đủ mạnh để chịu được tác động liên tục của các phân tử xung quanh và đảm bảo sự ổn định về hình dạng của các cấu trúc sinh học cao phân tử. Đồng thời, khi có tác động của các phân tử hoạt động, các liên kết hydro bị phá vỡ theo chu kỳ, sau đó được khôi phục trở lại, đảm bảo dòng chảy của các quá trình sống khác nhau. Các ví dụ được xem xét minh họa rõ ràng nhiều ứng dụng của phương pháp MO LCAO hơn so với phương pháp VS. Tuy nhiên, phương pháp VS có thể được sử dụng thành công để dự đoán các tính chất và cấu trúc của nhiều chất, bao gồm cả các hợp chất phức tạp. 32. Các nguyên tố vĩ mô và vi lượng trong môi trường và trong cơ thể người Có nhiều cách phân loại các nguyên tố hóa học có trong cơ thể con người. Vì vậy, V. I. Vernadsky, tùy thuộc vào hàm lượng trung bình (phần khối lượng w,%) trong cơ thể sống, đã chia các nguyên tố theo hệ thống mười ngày. Theo cách phân loại này, các nguyên tố chứa trong cơ thể sống được chia thành ba nhóm: nguyên tố vĩ mô, vi lượng và siêu vi lượng. Macronutrients Đây là những nguyên tố có hàm lượng trong cơ thể cao hơn 102%. Chúng bao gồm oxy, carbon, hydro, nitơ, phốt pho, lưu huỳnh, canxi, magiê, natri và clo. Phần tử theo dõi Đây là những phần tử có hàm lượng trong phần thân nằm trong khoảng 103 để 105%. Chúng bao gồm iốt, đồng, asen, flo, brom, stronti, bari, coban. Thành phần siêu nhỏ Đây là những phần tử có nội dung trong phần thân dưới 105%. Chúng bao gồm thủy ngân, vàng, uranium, thorium, radium, v.v. Hiện nay, các nguyên tố siêu vi lượng được kết hợp với các nguyên tố vi lượng thành một nhóm. Cách phân loại này chỉ phản ánh hàm lượng của các nguyên tố trong cơ thể sống mà không chỉ ra được vai trò sinh học và ý nghĩa sinh lý của nguyên tố này hay nguyên tố kia. V. V. Kovalsky, dựa trên tầm quan trọng của chúng đối với sự sống, đã chia các nguyên tố hóa học thành ba nhóm. Yếu tố quan trọng (không thể thay thế) Chúng thường xuyên được chứa trong cơ thể con người, là một phần của các enzym, hormone và vitamin: H, O, Ca, N, K, P, Na, S, Mg, d, C, I, Mn, Cu, Co, Fe, Zn, Mo, V. Sự thiếu hụt của chúng dẫn đến cuộc sống bình thường của con người bị gián đoạn. yếu tố tạp chất Những nguyên tố này thường xuyên được tìm thấy trong cơ thể động vật và con người: Ga, Sb, Sr, Br, F, B, Be, Li, Si, Sn, Cs, Al, Ba, Ge, As, Rb, Pb, Ra, Bi, Cd, Cr, Ni, Ti, Ag, Th, Hg, U, Se. Vai trò sinh học của chúng còn ít được hiểu rõ hoặc chưa được biết đến. yếu tố tạp chất Sc, Tl, In, La, Pr, Sm, W, Re, Tb, v.v. Tìm thấy ở người và động vật. Dữ liệu về số lượng và vai trò sinh học vẫn chưa được làm rõ. Các yếu tố cần thiết cho việc xây dựng và hoạt động quan trọng của các tế bào và sinh vật khác nhau được gọi là các yếu tố sinh học. Vẫn không thể liệt kê chính xác tất cả các nguyên tố sinh học do khó xác định nồng độ rất thấp của các nguyên tố vi lượng và thiết lập chức năng sinh học của chúng. Đối với 24 nguyên tố, tính sinh học được thiết lập một cách đáng tin cậy. Đây là các nguyên tố của nhóm thứ nhất và một số nguyên tố của nhóm thứ hai (theo Kowalski). 33. Địa hình của các yếu tố sinh học quan trọng nhất trong cơ thể con người Các cơ quan của con người tập trung khác nhau các nguyên tố hóa học khác nhau, tức là các nguyên tố vi mô và vĩ mô được phân bố không đồng đều giữa các cơ quan và mô khác nhau. Hầu hết các nguyên tố vi lượng tích tụ trong gan, xương và các mô cơ. Các mô này là kho (dự trữ) chính của nhiều nguyên tố vi lượng. Các nguyên tố có thể thể hiện ái lực cụ thể đối với một số cơ quan nhất định và được chứa trong chúng ở nồng độ cao. Ai cũng biết rằng kẽm tập trung ở tuyến tụy, iốt - trong tuyến giáp, flo - trong men răng, nhôm, asen, vanadi tích tụ trong tóc và móng, cadmium, thủy ngân, molypden - trong thận, thiếc - trong mô ruột, stronti - trong tuyến tiền liệt, mô xương, bari - trong võng mạc sắc tố của mắt, brom, mangan, crom - trong tuyến yên, v.v. d. Trong sinh vật, các nguyên tố vi lượng có thể ở trạng thái liên kết và ở dạng ion tự do. Được biết, silicon, nhôm, đồng và titan trong các mô não ở dạng phức hợp với protein, trong khi mangan ở dạng ion. Hydro và oxy là chất dinh dưỡng đa lượng. Chúng là một phần của nước, trung bình chứa khoảng 65% trong cơ thể một người trưởng thành. Nước phân bố không đều trên các cơ quan, mô và chất lỏng sinh học của con người. Vì vậy, trong dịch dạ dày, nước bọt, huyết tương, bạch huyết, nước chiếm từ 89,5 đến 90%, trong nước tiểu, chất xám của não, thận - 80%, trong chất trắng của não, gan, da, tủy sống, cơ, phổi, tim - 70-80%. Ít nhất - 40% nước - được chứa trong bộ xương. Các chất dinh dưỡng đa lượng - carbon, hydro, oxy, nitơ, lưu huỳnh, phốt pho - là một phần của protein, axit nucleic và các hợp chất hoạt tính sinh học khác của cơ thể. Hàm lượng carbon trong protein là 51-55%, oxy - 22-24%, nitơ - 15-18%, hydro - 6,5-7%, lưu huỳnh - 0,3-2,5%, phốt pho - khoảng 0,5%. Carbon, hydro và oxy cũng là một phần của carbohydrate, hàm lượng trong các mô động vật thấp - khoảng 2%. Những yếu tố này là một phần của lipid (chất béo). Ngoài ra, thành phần của phospholipid bao gồm phốt pho ở dạng nhóm phốt phát. Lipid tập trung nhiều nhất ở não (12%), sau đó đến gan (5%), sữa (2-3%) và huyết thanh (0,6%). Tuy nhiên, phần chính của phốt pho (600 g) được tìm thấy trong mô xương. Đây là 85% khối lượng của tất cả phốt pho trong cơ thể con người. Phốt pho cũng tập trung trong các mô cứng của răng, trong đó nó được bao gồm cùng với canxi, clo, flo ở dạng hydroxyl, clo, fluoropatites có công thức chung Ca5 (PO4)3X, trong đó X = OH, CI, F tương ứng. Canxi chủ yếu tập trung trong xương, cũng như trong các mô răng. Natri và clo chủ yếu được tìm thấy trong dịch ngoại bào, trong khi kali và magiê được tìm thấy trong dịch nội bào. Ở dạng florua, natri và kali là một phần của mô xương và răng. Magiê dưới dạng Mg Phosphate3 (P.O.4)2 chứa trong các mô cứng của răng. Hormone liên quan đến việc duy trì một hàm lượng nhất định các nguyên tố vĩ mô và vi lượng trong cơ thể. 34. Vai trò sinh học của các nguyên tố hóa học đối với cơ thể Vai trò sinh học của các nguyên tố hóa học đối với cơ thể con người là vô cùng đa dạng. Chức năng chính của các chất dinh dưỡng đa lượng là xây dựng các mô, duy trì áp suất thẩm thấu không đổi, thành phần ion và axit-bazơ. Các nguyên tố vi lượng, là một phần của enzyme, hormone, vitamin, hoạt chất sinh học như tác nhân tạo phức hoặc chất kích hoạt, tham gia vào quá trình trao đổi chất, quá trình sinh sản, hô hấp mô và trung hòa các chất độc hại. Các nguyên tố vi lượng ảnh hưởng tích cực đến các quá trình tạo máu, oxy hóa, khử, tính thấm của mạch máu và mô. Các nguyên tố vĩ mô và vi lượng - canxi, phốt pho, flo, iốt, nhôm, silic - quyết định sự hình thành các mô xương và răng. Nhiều bệnh liên quan đến sự thiếu hụt hoặc tích tụ quá mức các nguyên tố vi lượng khác nhau đã được xác định. Thiếu flo gây sâu răng, thiếu i-ốt - bệnh bướu cổ đặc hữu, thừa molypden - bệnh gút đặc hữu. Các mô hình như vậy có liên quan đến thực tế là sự cân bằng nồng độ tối ưu của các nguyên tố sinh học được duy trì trong cơ thể con người - cân bằng nội môi hóa học. Vi phạm sự cân bằng này do thiếu hoặc thừa nguyên tố có thể dẫn đến các bệnh khác nhau. Ngoài sáu chất dinh dưỡng đa lượng chính - các chất hữu cơ (cacbon, hydro, nitơ, oxy, lưu huỳnh và phốt pho), tạo nên carbohydrate, chất béo, protein và axit nucleic, các chất dinh dưỡng đa lượng vô cơ - canxi, clo, magiê, kali, natri - và vi lượng các nguyên tố - đồng, flo, iốt, sắt, molypden, kẽm, và cũng có thể (nó đã được chứng minh đối với động vật), - selen, asen, crom, niken, silic, thiếc, vanadi. Phân tích hàm lượng và tỷ lệ các nguyên tố vi lượng trong cơ thể người cũng được sử dụng trong giám định pháp y. Ví dụ, trong trường hợp ngộ độc rượu, dưới ảnh hưởng của rượu etylic, hàm lượng canxi trong gan tăng lên, natri và kali trở nên ít hơn. Đồng thời, ở tim và thận thì ngược lại, hàm lượng canxi giảm dần. Việc thiếu các nguyên tố như sắt, đồng, flo, kẽm, i-ốt, canxi, phốt pho, magiê và một số nguyên tố khác trong chế độ ăn uống dẫn đến nhiều hậu quả nghiêm trọng cho sức khỏe con người. Tuy nhiên, cần phải nhớ rằng không chỉ thiếu hụt mà còn dư thừa các nguyên tố sinh học cũng có hại cho cơ thể, vì điều này làm rối loạn cân bằng nội môi hóa học. Các thành phần khoáng chất, quan trọng với lượng không đáng kể, trở nên độc hại ở nồng độ cao hơn. Một số nguyên tố (bạc, thủy ngân, chì, cadmium, v.v.) được coi là độc hại, vì khi xâm nhập vào cơ thể, dù chỉ ở một lượng nhỏ, cũng dẫn đến các hiện tượng bệnh lý nghiêm trọng. Các nguyên tố khác nhau và các hợp chất của chúng được sử dụng rộng rãi làm thuốc. Như vậy, việc nghiên cứu vai trò sinh học của các nguyên tố hóa học, làm sáng tỏ mối quan hệ giữa sự trao đổi các nguyên tố này với các chất có hoạt tính sinh học khác (enzym, hormone, vitamin) góp phần tạo ra thuốc mới và xây dựng phác đồ liều lượng tối ưu cho cả mục đích điều trị và dự phòng. 35. Nguyên tố S và hợp chất của chúng Nước là một trong những hợp chất hydro quan trọng và phổ biến nhất trên Trái đất. Không gian nước chiếm gần 75% bề mặt địa cầu. Cơ thể người trưởng thành chứa trung bình 65-67% nước, thai nhi (4 tháng) - 94%, ở trẻ sơ sinh - 74%. Tất cả các phản ứng hóa học trong cơ thể chỉ xảy ra trong môi trường nước. Cuộc sống không có nước là không thể. Nước cất là một chế phẩm dược điển. Trong thực hành y tế, một hợp chất hydro khác được sử dụng - hydro peroxit H2 02. Hợp chất này là một sản phẩm phụ quan trọng của quá trình trao đổi chất. Hydrogen peroxide là một chất lỏng không màu, trong suốt. Gây bỏng khi tiếp xúc với da và niêm mạc. Phân tử H2О2 cực. Sự hiện diện của các cặp electron đơn độc tại các nguyên tử oxy cho phép hình thành liên kết cho-nhận của hydro peroxide với các phối tử - chất nhận điện tử. Trạng thái oxi hóa của oxi trong H2О2 bằng 1, tức là nó có giá trị trung gian giữa trạng thái oxy hóa của oxy trong nước (2) và trong oxy nguyên tố O2 . Từ đó hydro peroxit có thể thể hiện cả tính chất của một chất oxi hóa và tính chất của một chất khử (lưỡng tính oxi hóa khử). Tuy nhiên, đánh giá bằng các thế bán phản ứng oxy hóa khử tiêu chuẩn, tính chất oxy hóa đặc trưng hơn của hydro peroxit. Hydrogen peroxide tinh khiết không ổn định về mặt nhiệt động lực học và khi ở trạng thái đứng, phân hủy mạnh thành nước và oxy, giải phóng một lượng lớn nhiệt. Dung dịch nước của hydro peroxide ổn định hơn, ở nơi mát mẻ, chúng có thể được lưu trữ trong một thời gian dài. Hydrogen peroxide thường được bán ở dạng dung dịch nước 30% - perhydrol. Quá trình đồng phân hủy hydrogen peroxide được tăng tốc đáng kể khi có mặt các muối của kim loại nặng. Sự phân hủy hydro peroxit được xúc tác bằng ion kim loại có thể dẫn đến sự hình thành các gốc, trong đó quan trọng nhất là hydroxit HO và hydroperoxit. Độc tính là do thực tế rằng2О2 và về2 tương tác với lớp lipid của màng tế bào và làm hỏng chúng. Trong thực hành y tế, hydrogen peroxide chủ yếu được sử dụng như một tác nhân diệt khuẩn bên ngoài. Hành động H2О2 dựa trên khả năng oxy hóa của hydro peroxide và tính vô hại của sản phẩm khử của nó - nước. Khi điều trị vết thương, oxy được giải phóng đóng một vai trò kép: 1) có tác dụng kháng khuẩn, khử mùi và khử mùi, tiêu diệt các cơ thể vi sinh vật; 2) tạo bọt, góp phần chuyển đổi các hạt phân hủy mô sang trạng thái lơ lửng và làm sạch vết thương. Như một chế phẩm dược điển, dung dịch nước oxy già 3% được sử dụng, dung dịch nước oxy già 6% được sử dụng để tẩy trắng tóc. Ở dạng dung dịch 30%, hydrogen peroxide được sử dụng để điều trị dạng mụn cóc của liken phẳng và để loại bỏ mụn cóc trẻ em. 36. Vai trò sinh học của các nguyên tố s thuộc nhóm IA (liti, rubidi, xêzi, franxi) Theo nội dung trong cơ thể con người, natri (0,08%) và kali (0,23%) là các chất dinh dưỡng đa lượng và phần còn lại của kim loại kiềm là lithium (104%), rubidi (105%), xêzi (104%) - đến các nguyên tố vi lượng. Lithium Hàm lượng lithium trong cơ thể con người là khoảng 70 mg (10 mmol) - 104%. Các hợp chất liti ở động vật bậc cao tập trung ở gan, thận, lá lách, phổi, máu và sữa. Lượng lithium tối đa được tìm thấy trong cơ bắp của con người. Vai trò sinh học của liti như một nguyên tố vi lượng vẫn chưa được làm sáng tỏ đầy đủ. Người ta đã chứng minh rằng ở cấp độ màng tế bào, các ion Li (ở nồng độ vừa đủ) cạnh tranh với các ion natri khi thâm nhập vào tế bào. Rõ ràng, sự thay thế các ion Na trong tế bào bằng các ion Li có liên quan đến cộng hóa trị lớn hơn của các hợp chất liti, do đó chúng hòa tan tốt hơn trong các phospholipid. Người ta đã chứng minh rằng một số hợp chất lithium có tác dụng tích cực đối với bệnh nhân hưng cảm trầm cảm. Được hấp thụ qua đường tiêu hóa, các ion Li tích tụ trong máu. Khi nồng độ của ion Li đạt từ 0,6 mmol / l trở lên, thì sự căng thẳng về cảm xúc sẽ giảm đi và sự kích thích hưng cảm yếu đi. Đồng thời, hàm lượng ion Li trong huyết tương phải được kiểm soát chặt chẽ. Trong trường hợp nồng độ của ion Li vượt quá 1,6 mmol / l, hiện tượng tiêu cực có thể xảy ra. rubidi và xêzi Theo hàm lượng rubidium trong cơ thể con người (105%) và xêzi (104%) thuộc nguyên tố vi lượng. Chúng liên tục được chứa trong cơ thể, nhưng vai trò sinh học của chúng vẫn chưa được làm sáng tỏ. Là một chất tương tự hoàn toàn của kali, rubidi cũng tích tụ trong chất lỏng nội bào và có thể thay thế một lượng kali tương đương trong các quá trình khác nhau. đồng vị phóng xạ 13rCs và 87Rb được sử dụng trong xạ trị các khối u ác tính, cũng như trong nghiên cứu chuyển hóa kali. Do sự phân hủy nhanh chóng, chúng thậm chí có thể được đưa vào cơ thể mà không sợ những tác hại lâu dài. Nước pháp Đây là một nguyên tố hóa học phóng xạ thu được bằng phương pháp nhân tạo. Có bằng chứng cho thấy rằng franxi có thể tích tụ có chọn lọc trong các khối u ở giai đoạn phát triển sớm nhất của chúng. Những quan sát này có thể hữu ích trong việc chẩn đoán ung thư. Như vậy, trong các nguyên tố nhóm IA thì Li, Rb, Cs có hoạt tính sinh lý, còn Na và K có hoạt tính sống. Sự gần gũi về tính chất hóa lý của Li và Na, do sự giống nhau về cấu trúc điện tử của các nguyên tử của chúng, cũng được thể hiện trong hoạt động sinh học của các cation (tích tụ trong dịch ngoại bào, khả năng thay thế lẫn nhau). Bản chất tương tự của hoạt động sinh học của các cation của các nguyên tố có chu kỳ lớn - K+, rb+, Cs+ (tích tụ trong dịch nội bào, thay thế cho nhau) cũng do sự giống nhau về cấu trúc điện tử và tính chất lý hóa của chúng. Đây là cơ sở để sử dụng các chế phẩm natri và kali trong trường hợp ngộ độc với các muối lithium và rubidi. 37. Vai trò sinh học của các nguyên tố s thuộc nhóm IA (natri, kali) Hàm lượng natri trong cơ thể người nặng 70 kg là khoảng 60 g (2610 mmol) - 0,08%. Trong số này, 44% natri nằm trong dịch ngoại bào và 9% trong dịch nội bào. Phần natri còn lại nằm trong mô xương, là nơi lắng đọng ion Na trong cơ thể. Khoảng 40% natri có trong mô xương tham gia vào các quá trình trao đổi chất và do đó, bộ xương là chất cho hoặc chất nhận ion Na, giúp duy trì nồng độ ion Na không đổi trong dịch ngoại bào. Natri là ion ngoại bào chính. Trong cơ thể con người, natri ở dạng muối hòa tan, chủ yếu là clorua, phốt phát và hydro cacbonat. Natri được phân phối khắp cơ thể: trong huyết thanh, dịch não tủy, dịch mắt, dịch tiêu hóa, mật, thận, da, mô xương, phổi và não. Các ion Na đóng một vai trò quan trọng trong việc đảm bảo tính ổn định của môi trường bên trong cơ thể con người, tham gia vào việc duy trì áp suất thẩm thấu không đổi của chất lỏng sinh học (cân bằng nội môi thẩm thấu). Các ion Na tham gia vào quá trình điều hòa chuyển hóa nước và ảnh hưởng đến hoạt động của các enzym. Cùng với các ion K, Mg, Ca, Cl, ion Na tham gia vào quá trình truyền các xung thần kinh và duy trì khả năng hưng phấn bình thường của tế bào cơ. Khi hàm lượng natri trong cơ thể thay đổi sẽ dẫn đến rối loạn chức năng của hệ thần kinh, tim mạch và các hệ thống khác, cơ trơn và cơ xương. Natri clorua NaCl là nguồn cung cấp axit clohydric chính cho dịch vị. Natri đi vào cơ thể con người chủ yếu dưới dạng muối ăn. Nhu cầu thực sự hàng ngày của cơ thể đối với natri là 1 g, mặc dù lượng tiêu thụ trung bình của nguyên tố này đạt 4-7 g. Dưới ảnh hưởng của kiềm trên tế bào vi sinh vật, xảy ra sự kết tủa của protein tế bào và kết quả là vi sinh vật chết. Natri sunfat (muối của Glauber) Na2SO4 × 10H2O được dùng làm thuốc nhuận tràng. Natri tetraborat Na2B4О7 × 10H2O được sử dụng bên ngoài như một chất khử trùng để rửa, thụt rửa, bôi trơn. Natri hydroxit ở dạng dung dịch 10% là một phần của silin được sử dụng trong thực hành chỉnh hình để đúc các mô hình chịu lửa trong sản xuất các bộ phận giả đúc từ hợp kim coban-crom. Hàm lượng kali trong cơ thể người nặng 70 kg là khoảng 160 g (4090 mmol) - 0,23%. Kali là cation nội bào chính, chiếm 2/3 tổng số cation hoạt động của tế bào. Trong tổng lượng kali có trong cơ thể, 98% nằm bên trong tế bào và chỉ khoảng 2% nằm trong dịch ngoại bào. Kali được phân phối khắp cơ thể. Địa hình của nó: gan, thận, tim, mô xương, cơ, máu, não, v.v. Các ion K đóng vai trò quan trọng trong các quá trình sinh lý - co cơ, hoạt động bình thường của tim, dẫn truyền xung thần kinh, phản ứng trao đổi chất. Các ion K là chất kích hoạt quan trọng của các enzym nằm bên trong tế bào. 38. Vai trò sinh học của các nguyên tố s thuộc nhóm IIA. Công dụng của chúng trong y học (berili, magiê, canxi) Berili được tìm thấy trong thực vật cũng như trong các sinh vật động vật. Hàm lượng berili trong cơ thể sống là 107%, tức là nó là chất siêu vi lượng tạp chất. Vai trò sinh học của berili vẫn chưa được nghiên cứu đầy đủ. Các hợp chất berili rất độc và gây ra một số bệnh (còi xương do berili, bệnh berylliosis, v.v.). Các hợp chất dễ bay hơi của beri đặc biệt độc. Ảnh hưởng tiêu cực của Be2 + đối với các quá trình sinh lý được giải thích bằng các tính chất hóa học của nó. Magiê chính thức là một chất dinh dưỡng đa lượng. Tổng hàm lượng của nó trong cơ thể là 0,027% (khoảng 20 g). Địa hình của magie trong cơ thể con người như sau: magie tập trung nhiều nhất ở ngà răng và men răng, mô xương. Nó cũng tích tụ trong tuyến tụy, cơ xương, thận, não, gan và tim. Ở người trưởng thành, nhu cầu magie hàng ngày là khoảng 0,7 g Ion Mg, giống như ion K, là một cation nội bào. Trong chất lỏng và mô sinh học của cơ thể, magiê được tìm thấy ở cả dạng ion nước và ở trạng thái liên kết với protein với số lượng <102%, tức là, về bản chất, nó là một nguyên tố vi lượng. Nồng độ của ion Mg bên trong tế bào cao hơn trong dịch ngoại bào khoảng 2,5-3 lần. Các ion magiê đóng một vai trò sinh học quan trọng trong cơ thể con người. Do bán kính ion nhỏ hơn và năng lượng ion hóa của Mg cao hơn2+ tạo thành liên kết mạnh hơn ion Ca, và do đó là chất xúc tác tích cực hơn cho các quá trình enzym. Là một phần của các hệ thống enzym khác nhau, ion Mg là thành phần và chất kích hoạt không thể thiếu của chúng (các enzym như carboxypeptidase, cholinesterase và một số enzym khác đặc trưng cho ion Mg). Quá trình thủy phân ATP, liên quan đến một số phản ứng enzyme, do đó quá trình hydrophotphat HPO2 được hình thành và một lượng lớn năng lượng được giải phóng, diễn ra với lượng dư thừa Mg2+. Canxi là một chất dinh dưỡng đa lượng. Tổng hàm lượng của nó trong cơ thể là 1,4%. Canxi được tìm thấy trong mọi tế bào của cơ thể con người. Phần lớn canxi được tìm thấy trong các mô xương và răng. Trung bình một người trưởng thành nên tiêu thụ 1 g canxi mỗi ngày, mặc dù nhu cầu canxi chỉ là 0,5 g. Hấp thu tương đối kém là hậu quả của việc hình thành canxi photphat Ca ít hòa tan trong đường tiêu hóa3(PO4)2 và muối canxi của axit béo. Trong cơ thể, nồng độ ion Ca được điều hòa bởi các hormone. Trong xương và răng của một người trưởng thành, khoảng 1 kg canxi ở dạng khoáng chất kết tinh không hòa tan - hydroxyapatite Ca10(RO4)6(ANH TA)2 , sự hình thành xảy ra trong quá trình tương tác của các ion Ca với phốt phát. Trong máu và bạch huyết, canxi được tìm thấy ở cả trạng thái ion hóa và không ion hóa - trong các hợp chất với protein, carbohydrate, v.v. Cơ chế đông máu bao gồm một số giai đoạn, tùy thuộc vào sự hiện diện của Ca bị ion hóa. Ion Ca tham gia vào quá trình dẫn truyền xung thần kinh, co cơ, điều hòa cơ tim. Nồng độ các ion Ca trong và ngoài tế bào lần lượt là 106 và (2,25-2,8) 103 mol/l. Vì canxi thực tế không được sử dụng bên trong tế bào nên nó hoạt động như một vật liệu xây dựng trong cơ thể - trong xương, răng. Bộ xương là nơi lưu trữ canxi chính của cơ thể. 39. Vai trò sinh học của các nguyên tố d thuộc nhóm VIB. Công dụng của chúng trong y học Crom được tìm thấy trong sinh vật động thực vật. Cơ thể của một người trưởng thành chứa khoảng 6 g Cr (0,1%). Kim loại crom không độc, còn các hợp chất Cr (III) và Cr (VI) thì nguy hại cho sức khỏe. Chúng gây kích ứng da, từ đó dẫn đến viêm da. Có một giả định rằng các dẫn xuất của crom (VI) có đặc tính gây ung thư. 0,25-0,3 g kali dicromat gây chết. Các hợp chất crom (VI) được sử dụng làm thuốc diệt nấm (chất tẩy, nấm - "nấm", caldere - "giết"). Các hợp chất crom (III) có tác dụng có lợi đối với sự phát triển của thực vật. Molypden thuộc về "kim loại của sự sống", là một trong những nguyên tố sinh học quan trọng nhất. Vị trí đặc biệt của nó đã được F. Krin và L. Oril ghi nhận cách đây 20-25 năm. Các nhà khoa học này đưa ra ý tưởng rằng sự xuất hiện của sự sống trên Trái đất không phải do quá trình tiến hóa xảy ra mà nó được mang đến bởi một nền văn minh chưa được biết đến từ không gian từ các ngôi sao molypden, nơi sự sống đã tồn tại trước chúng ta rất lâu. Trong các quá trình sinh hóa, molypden tham gia vào các trạng thái oxy hóa VI và VI. Ở những trạng thái này, nó tạo ra các dạng oxo ổn định. Molypden tạo thành phức hợp oxo ổn định và do đó, rõ ràng, nó là một phần của các enzym đảm bảo việc chuyển các nhóm oxo. Mo (VI) chiếm ưu thế trong máu; nếu phối tử là oxy, thì các isopolymolybdation ổn định được hình thành. Hàm lượng quá nhiều molypden trong thực phẩm làm rối loạn chuyển hóa Ca2+ và RO4 , gây giảm sức mạnh của xương - loãng xương. Có lẽ liên kết vào phức hợp phosphomolypden xảy ra. Những phức hợp như vậy có thể được coi là dư lượng axit của axit heteropolymolybdic. Với canxi, những cặn này tạo thành các tinh thể không hòa tan. Có thể những tinh thể này bắt đầu lắng đọng muối axit uric và gây ra bệnh gút. Bệnh gút làm biến dạng các khớp, biện minh cho bản dịch theo nghĩa đen của nó - "cái bẫy chân". Ngoài các phức chất oxy, molypden tạo thành các phức hợp halogenua (Hal), thiocyanat (NCS) và xyanua (CN). Molypden là thành phần cấu tạo của nhiều loại enzym khác nhau. Trong cơ thể con người, chúng bao gồm aldehyde hydroxydases, xanthine dehydrogenases và xanthine oxidases. Trọng lượng phân tử của xanthine oxidase (COX) là 250 a.u. e. m. Đây là một loại enzyme chứa molypden của động vật có vú. Nó có thể xúc tác quá trình oxy hóa xanthine và các purin khác, cũng như các aldehyde. Quá trình chuyển đổi hypoxanthine và xanthine thành axit uric được xúc tác bởi xanthine oxidase. Giả thiết rằng trong quá trình xúc tác, molypden tạo liên kết với nitơ và oxy của xanthine. Molypden là nguyên tố vi lượng quan trọng nhất của thực vật, vì các chất hoạt tính sinh học với sự tham gia của nó giúp cố định nitơ nhẹ: chúng chuyển hóa nó thành amoniac hoặc các sản phẩm chứa nitơ. So với các kim loại quan trọng trong công nghiệp khác, molypden có độc tính thấp. Mức tiêu thụ molypden với thức ăn là 0,1 - 0,3 mg / ngày, nhưng lượng cần thiết hàng ngày vẫn chưa được thiết lập. Sự thiếu hụt molypden gây ra sự giảm hoạt động của xanthine oxidase trong các mô. Hàm lượng molypden quá cao gây loãng xương. Vonfram là một nguyên tố vi lượng. Vai trò của nó đối với cơ thể vẫn chưa được hiểu rõ. Dạng anion của vonfram được hấp thu dễ dàng trong đường tiêu hóa. Vonfram kim loại và các dạng cation của nó không được hấp thụ trong cơ thể. Không có thông tin về cân bằng nội môi vonfram ở động vật có vú. 40. Vai trò sinh học của các hợp chất mangan. Công dụng của chúng trong y học Trong số các nguyên tố thuộc nhóm VIIB, chỉ có mangan là nguyên tố sinh học và là một trong mười "kim loại của sự sống" cần thiết cho quá trình bình thường của các cơ thể sống. Cơ thể của một người trưởng thành chứa 12 mg. Mangan tập trung trong xương (43%), phần còn lại - trong các mô mềm, bao gồm cả não. Trong cơ thể, mangan tạo phức kim loại với protein, axit nucleic, ATP, ADP, các axit amin riêng lẻ. Chứa mangan metalloenzyme arginase, cholinesterase, phosphoglucomutase, pyruvate carboxylase. Sự liên kết của amoniac - một sản phẩm độc hại của quá trình biến đổi axit amin trong cơ thể động vật có vú - được thực hiện thông qua axit amin arginine. Arginase là enzym xúc tác quá trình thủy phân arginine ở gan. Kết quả là, arginine bị phân hủy thành urê và axit amin vòng ornithine. Urê là một chất không độc, tan trong nước. Nó được mang theo dòng máu đến thận và bài tiết qua nước tiểu. Bán kính nguyên tử của mangan là 128 pm. Điều này giải thích thực tế là mangan có thể thay thế magiê (bán kính nguyên tử 160 pm) trong sự kết hợp của nó với ATP, ảnh hưởng đáng kể đến việc chuyển giao năng lượng trong cơ thể. Các ion Mg và Mn cũng thực hiện hoạt hóa các enzym - nuclease. Các enzym này xúc tác quá trình thủy phân axit nucleic DNA và RNA trong tá tràng. Kết quả là, các chất độc sinh học này được chia thành các đơn vị đơn phân - nucleotide. Đặc biệt, một nuclease như vậy là deoxyribonuclease, xúc tác cho quá trình thủy phân DNA chỉ với sự có mặt của Mg2+ hoặc Mn2+. Mangan cũng có thể là một phần của các hợp chất vô cơ trong cơ thể. Ví dụ, đây là một magie pyrophosphat mangan hòa tan kém MnMgP2O7. Các tinh thể của muối này khu trú trên bề mặt bên trong của màng túi. Giá trị bán kính nguyên tử của mangan và sắt gần như giống nhau giải thích khả năng mangan thay thế sắt trong phức hợp porphyrin của hồng cầu. Vì lý do tương tự, mangan cũng có thể thay thế kẽm trong các enzym phụ thuộc kẽm, do đó thay đổi tính chất xúc tác của chúng. Kali pemanganat KMnO4 - hợp chất mangan nổi tiếng nhất được sử dụng trong y học. Sử dụng dung dịch nước có chứa KMnO4 0,01-5%. Dung dịch 5% được dùng làm chất cầm máu. Dung dịch kali pemanganat có tính chất khử trùng, được xác định bởi khả năng oxy hóa cao của nó. Trong số các hợp chất mangan khác, cần lưu ý mangan (II) sulfat và mangan (II) clorua, được sử dụng trong điều trị bệnh thiếu máu. Không có dữ liệu về sự hiện diện của tecneti trong cơ thể sống. Tuy nhiên, các hợp chất tecneti với bisphosphonat được sử dụng cho phương pháp chẩn đoán đồng vị phóng xạ. 41. Vai trò sinh học của hợp chất sắt. Huyết sắc tố Sắt là một nguyên tố sinh học được tìm thấy trong các mô của động vật và thực vật. Tổng khối lượng sắt trong cơ thể của một người trưởng thành là khoảng 5 g, chiếm 0,007%. Sắt kim loại có độc tính thấp, và các hợp chất Fe (II), Fe (III) và Fe (VI) với số lượng lớn gây nguy hại cho sức khỏe. Myoglobin, cytochromes, catalase cung cấp cho quá trình hô hấp của tế bào. Tất cả các protein này bao gồm các phần protein riêng và các trung tâm hoạt động liên kết với chúng. Trung tâm hoạt động là một hợp chất phức tạp vòng lớn - heme. Hợp chất porphyrin hoạt động như một phối tử vòng lớn. Các nguyên tử nitơ của nhà tài trợ nằm ở các góc của hình vuông, ở trung tâm có ion Fe. Nói chung, phức chất có cấu hình bát diện. Quỹ đạo thứ năm thông qua nitơ của axit amin (histidine) được sử dụng để liên kết heme với protein. Hemoglobin bao gồm 4 phân tử protein (tiểu đơn vị) tạo thành một tập hợp đại phân tử duy nhất. Mỗi tiểu đơn vị có cấu trúc tương tự như phân tử myoglobin. Do đó, hemoglobin có thể liên kết đồng thời bốn phân tử O2 , và myoglobin - 1. Ngoài ra còn có một số phức hợp protein chứa sắt không phải heme trong các mô. Ví dụ, đây là các enzym - oxidase, cũng như protein - chất lưu trữ (kho) và chất mang sắt. Sắt dư thừa được vận chuyển trong máu bởi protein transferrin và tích tụ dưới dạng protein ferritin trong các mô và cơ quan khác nhau, đặc biệt là ở gan, lá lách và tủy xương. Ferritin bao gồm 24 phân tử protein (tiểu đơn vị) tạo thành hình cầu có đường kính 12-14 nm. Mỗi tiểu đơn vị chứa một khoang có đường kính 7 nm chứa tới 4500 nguyên tử sắt. Do đó, mỗi tập hợp ferritin có thể lưu trữ khoảng 100 nguyên tử sắt, cung cấp nhiều phản ứng trao đổi chất liên quan đến nguyên tố này. Dựa trên quy luật cân bằng hóa học, không khó để hiểu hoạt động của hemoglobin như một chất vận chuyển oxy từ phổi đến các mô. Hemoglobin không có oxy (deoxyhemoglobin) là một axit yếu và công thức hóa học của nó có thể được biểu diễn dưới dạng HHb+. Việc bổ sung oxy đi kèm với việc loại bỏ một proton và oxyhemoglobin HbO được hình thành.2 . Trong trường hợp này, có một trạng thái cân bằng: hb+ + HOẶC2 → HbO2 + H+. Khi máu tĩnh mạch nghèo oxy đi vào phổi, nơi áp suất riêng phần của oxy cao (lên đến 20 kPa), độ hòa tan của nó tăng lên theo định luật Henry. Theo nguyên lý của Le Chatelier, điều này dẫn đến sự chuyển dịch cân bằng sang phải và hình thành oxyhemoglobin. Một sự chuyển dịch bổ sung của trạng thái cân bằng sang phải là do giá trị pH trong phổi được tăng lên (lên đến 7,5). Kết quả là trong phổi, deoxyhemoglobin gần như hoàn toàn (lên đến 97%) bão hòa với oxy và chuyển thành oxyhemoglobin. Trong các mao mạch thâm nhập vào các mô ngoại vi, áp suất riêng phần của oxy giảm xuống 5 kPa, và giá trị pH giảm xuống 7,2. Kết quả là, cân bằng dịch chuyển sang trái. Trong máu chảy từ ngoại vi, hemoglobin chỉ bão hòa với oxy 65%. 42. Vai trò sinh học của hợp chất sắt. CO cacbon monoxit. Tính chất phức hợp kim loại của protein chứa heme được thể hiện dưới tác động của các chất độc hại như CO (cacbon monoxide) và MCN (xyanua - muối của axit hydrocyanic). Điều quan trọng nhất từ quan điểm sinh lý là các protein chứa sắt: huyết sắc tố, myoglobin, cytochrom, peroxidase, catalase. Hemoglobin - thành phần chính của tế bào hồng cầu, đảm bảo hô hấp bên ngoài, là chất vận chuyển oxy từ phổi đến các mô. Sắt Fe và coban Co là những nguyên tố vi lượng cần thiết cho cơ thể sống. Carbon monoxide CO là một trong những sản phẩm của quá trình đốt cháy nhiên liệu không hoàn toàn. Một lượng đáng kể khí này được thải ra trong quá trình vận hành lò hơi, động cơ đốt trong và hút thuốc. Khi CO được hít vào cùng với không khí trong phổi song song với oxyhemoglobin HbO2 một hợp chất phức kim loại được hình thành - carbonyl hemoglobin HbCO. Hằng số ổn định của HbCO gấp khoảng 200 lần so với HbO2 . Do đó, ngay cả một lượng nhỏ CO cũng "chặn" một tỷ lệ đáng kể deoxyhemoglobin, do đó, việc cung cấp oxy cho các cơ quan giảm. Có dấu hiệu thiếu oxy - thiếu oxy. Mô thần kinh là người đầu tiên bị ảnh hưởng. Để giải độc (loại bỏ tác dụng độc hại) của carbon monoxide, trong nhiều trường hợp, chỉ cần ngừng cung cấp và tăng cường thông gió oxy là đủ - đưa nạn nhân ra nơi có không khí trong lành. Trong trường hợp này, nguyên tắc của Le Chatelier hoạt động trở lại - trạng thái cân bằng dịch chuyển theo hướng hình thành oxyhemoglobin. Ở nồng độ cao, carbon monoxide ngăn chặn các protein chứa heme của quá trình hô hấp tế bào, và rất khó để tránh kết quả gây chết người. Cơ chế hoạt động của các xyanua tương tự nhau, nhưng độc tính của chúng cao hơn so với CO. Sự xâm nhập vào máu của một lượng rất nhỏ các chất này dẫn đến ngừng hô hấp và tử vong. Độc tính cao của xyanua được giải thích là do độ bền cao của liên kết Fe-CN-, yếu tố này quyết định độ ổn định cao hơn của hemoglobin xyanua. Hô hấp oxy dẫn đến sự hình thành hydrogen peroxide H2O2 . Chất này có khả năng oxy hóa cao. Khi nó tương tác với các hợp chất hữu cơ sinh học của tế bào, các gốc được hình thành - các hạt phân tử rất tích cực với hóa trị không bão hòa và quá trình oxy hóa peroxide được bắt đầu. Dưới tác động của các gốc tự do, các thành phần quan trọng nhất của tế bào - màng và DNA - bị phá hủy. Trong quá trình tiến hóa sinh học, tự nhiên đã phát triển một loại protein đặc biệt - enzyme catalase, có tác dụng phá hủy hydro peroxide. Điều này hạn chế sự tích tụ dư thừa của chất này và ngăn chặn sự phá hủy tế bào. Hoạt động của catalase (CatFe2+ ) có thể được biểu diễn như một chu trình xúc tác của hai phản ứng liên tiếp: catfe2+ + H2O2 - Cát Fe2+ × H2O2 , catfe2+ × H2O2 + H2O2 → CátFe2+ + 2 giờ2O2 + HOẶC2 . Kết quả là 2 phân tử hydrogen peroxide bị phá hủy, đồng thời phân tử xúc tác sinh học CatFe2 + được giải phóng và có thể bước vào chu trình xúc tác tiếp theo. Quá trình này diễn ra rất nhanh. Trong vòng một giây, 1 phân tử catalase có thể thực hiện tới 20 chu kỳ. 43. Vai trò sinh học của hợp chất sắt và coban Khi thiếu sắt trong cơ thể, một căn bệnh có thể phát triển - thiếu máu do thiếu sắt (thiếu máu). Thiếu oxy mô liên quan đến thiếu sắt để tổng hợp hemoglobin. Kết quả là, sự phân phối oxy đến các cơ quan ngoại vi giảm, và theo đó, mức độ hô hấp của tế bào giảm, và quá trình trao đổi chất chậm lại. Việc sử dụng sắt (II) clorua hoặc sắt (II) sulfat làm thuốc làm giảm mức độ nghiêm trọng của bệnh. Với những mục đích tương tự, người ta sử dụng bột mịn của sắt kim loại (sắt đã khử, tối đa 1 g mỗi liều), chất này dễ hòa tan trong axit clohydric của dịch dạ dày. Do đó, tác dụng của thuốc này tương tự như tác dụng của sắt (II) clorua. Tuy nhiên, các loại thuốc là phức hợp vô cơ của sắt với đường, nicotinamide và các chất hữu cơ khác có hiệu quả hơn. Các phức hợp như vậy được hấp thu tốt vào máu, đó là lý do cho hiệu quả dược lý của chúng. Điều thú vị là từ thời cổ đại cho đến nay, cái gọi là rượu sắt được sử dụng để điều trị bệnh thiếu máu do thiếu sắt - một loại thức uống thu được bằng cách ngâm rượu nho vào mạt sắt. Rõ ràng, sắt hòa tan trong rượu (môi trường axit) và tạo thành phức chất với các chất hữu cơ tự nhiên có trong rượu với số lượng lớn. Rõ ràng là cơ chế hoạt động của thức uống cổ đại gần giống như cơ chế hoạt động của các loại thuốc hiện đại. Giống như sắt, coban cũng là một trong những nguyên tố sinh học quan trọng nhất. Tổng khối lượng coban trong cơ thể của một người trưởng thành là khoảng 1,2 mg, nhỏ hơn 10%. Khoảng 100 mg khối lượng này ở dạng cyanocobalamin (vitamin B tan trong chất béo12 ) và các chất tương tự của nó. Chất này, giống như heme, là một hợp chất phức tạp vòng lớn. Hợp chất tetradentate, porphin, hoạt động như một phối tử vòng lớn. R là một nhóm thế hữu cơ phức tạp. Trong các chất tương tự của cyanocobalamin, các nhóm thế hữu cơ khác nhau hoạt động thay vì anion CN. Vai trò quan trọng nhất của vitamin B12 đóng vai trò trong sự phát triển và hình thành các tế bào hồng cầu (tạo hồng cầu). Thiếu vitamin B12 (dùng ít hơn 3 mcg mỗi ngày) dẫn đến một căn bệnh nghiêm trọng - thiếu máu ác tính (thiếu máu). Người ta đã chứng minh rằng các chất tương tự của cyanocobalamin là chất hoạt hóa - đồng yếu tố của các enzym khác nhau liên quan đến quá trình tạo hồng cầu. Sự thiếu hụt các yếu tố đồng yếu tố thể hiện ở sự thiếu hụt huyết sắc tố và hồng cầu. Thực vật và động vật không thể tổng hợp vitamin B12. Nó chỉ được tạo ra bởi một số loại vi khuẩn. Những vi khuẩn này có trong đường tiêu hóa của con người. Chúng tổng hợp đủ vitamin B12. Thiếu máu ác tính có liên quan đến sự suy giảm hấp thu vitamin này vào máu. Do đó, việc uống thuốc không hiệu quả. Tiêm vitamin (100-200 mcg trong 2 ngày) vào máu giúp cải thiện đáng kể tình trạng của bệnh nhân bị thiếu máu ác tính. 44. Vai trò của các nguyên tố d của nhóm IB. Việc sử dụng các hợp chất của chúng trong y học Đồng Cu là nguyên tố vi lượng thiết yếu của cơ thể sống. Bạc Ag và vàng Au là các nguyên tố vi lượng tạp chất. Các hợp chất của chúng được sử dụng trong y học. Đồng là một nguyên tố sinh học được tìm thấy trong các mô của động vật và thực vật. Tổng khối lượng đồng trong cơ thể của một người trưởng thành là khoảng 100 mg, tức là khoảng 0,0001%. Khoảng 30% lượng này được tìm thấy trong các cơ. Gan và não cũng rất giàu đồng. Đồng kim loại và các hợp chất của nó là độc hại. Điều quan trọng nhất từ quan điểm sinh lý là các protein có chứa đồng - cytochrom oxydase và superoxide dismutase. Cytochrome oxidase là một trong những thành phần của chuỗi hô hấp nằm trong màng ti thể. Cung cấp cho quá trình hô hấp tế bào bằng cách khử oxy thành nước ở cuối chuỗi hô hấp. Cơ thể cần 2,5-5,0 mg đồng mỗi ngày. Khi cơ thể thiếu đồng, một căn bệnh có thể phát triển - thiếu máu do thiếu đồng. Đồng cần thiết cho sự hấp thụ sắt, đặc biệt, trong quá trình tổng hợp cytochrom oxydase, chứa cả sắt và đồng. Khi thiếu đồng, sự phát triển bình thường của các mô liên kết và mạch máu bị gián đoạn. Ngộ độc thường liên quan đến việc vô tình dùng quá liều thuốc diệt côn trùng, hít phải bột kim loại, uống phải dung dịch muối đồng. Đồ uống được đựng trong bình đồng mà không có lớp sơn bảo vệ thành bình rất nguy hiểm. Là một tác nhân bên ngoài, một dung dịch nước 0,25% của đồng sunfat CuSO được sử dụng.4 bị viêm màng nhầy và viêm kết mạc. Liều nhỏ của thuốc này có thể được thực hiện với thức ăn để tăng tạo hồng cầu trong bệnh thiếu máu. Bạc và vàng Khoảng 1 mg bạc, tức là khoảng 10% (1 ppm) và lên đến 10 mg vàng, tức là khoảng 10% (10 ppm), được tìm thấy trong cơ thể của một người trưởng thành. Tính chất khử trùng của muối bạc hòa tan đã được biết đến từ thời cổ đại. Từ lâu, các thầy tu đã biết rằng nước ("thánh") khi đựng trong bình bạc để lâu không bị biến chất, tức là không bị nhiễm vi sinh vật. Hiện tại, tài sản nước “bạc tỷ” này được các thủy thủ sử dụng trong những chuyến đi biển xa. Các biểu hiện nhiễm độc mạnh ở người lớn được quan sát thấy khi ăn phải 7 g AgNO.3. Trong y học, các loại thuốc như bạc nitrat tinh thể AgNO03 (lapis) và các dung dịch nước của nó đã được sử dụng từ lâu. Các chế phẩm bạc kim loại dạng keo protargol (8% Ag) và cổ tử cung (70% Ag) đã được biết đến từ lâu, là những chất bột mịn có ánh kim loại. Mỗi hạt bột như vậy là một tinh thể bạc kim loại đã khử có kích thước nhỏ hơn 1 μm với vỏ protein là albumin (protargol) hoặc collagen (cổ áo). Lớp vỏ protein bảo vệ các tinh thể bạc khỏi dính vào nhau và đảm bảo quá trình chuyển hóa của chúng vào môi trường nước (hòa tan). Các chế phẩm bạc được sử dụng như chất chống viêm, khử trùng và chất làm se. Các chế phẩm vàng cũng được sử dụng như một loại thuốc chống viêm hiệu quả. Được biết đến nhiều nhất là krizanol với hàm lượng 30% là kim loại quý và vàng dạng keo. 45. Vai trò sinh học của các nguyên tố d nhóm IIB. Việc sử dụng các hợp chất của chúng trong y học Kẽm Zn, cadimi Cd, thủy ngân Hg là các nguyên tố vi lượng. Cơ thể một người trưởng thành chứa 1,8 g Zn, 50 mg Cd, 13 mg Hg. Cadmium và thủy ngân là những nguyên tố tạp chất. Khoảng 70% thủy ngân tập trung ở các mô mỡ và cơ. Cadmium được khu trú 30% ở thận, phần còn lại - ở gan, phổi, tuyến tụy. Kẽm là một nguyên tố cần thiết cho tất cả các loài thực vật và động vật. Trong cơ thể của một người trưởng thành, hầu hết kẽm trong cơ (65%) và xương (20%). Phần còn lại rơi vào huyết tương, gan, hồng cầu. Nồng độ kẽm cao nhất trong tuyến tiền liệt. Kẽm không thể hiện hóa trị thay đổi. Do đó, rõ ràng, các chất tổng hợp sinh học của nó tham gia vào nhiều phản ứng thủy phân sinh hóa xảy ra mà không cần chuyển điện tử. Ion Zn là một phần của hơn 40 metalloenzyme xúc tác quá trình thủy phân este và protein. Một trong những phức hợp được nghiên cứu nhiều nhất là phức hợp kẽm vô cơ - enzyme carbonic anhydrase (Mg = 30), bao gồm khoảng 000 gốc axit amin. Kẽm không phải là một phần của dipeptidase - enzyme xúc tác quá trình thủy phân dipeptide (chất bao gồm 2 axit amin). Kẽm tạo thành phức hợp vô cơ sinh học với insulin, một loại hormone điều chỉnh lượng đường trong máu. Nhu cầu kẽm của con người được đáp ứng đầy đủ bởi các sản phẩm thực phẩm: thịt, sữa, trứng. Khi thiếu kẽm ở thực vật, quá trình chuyển hóa protein và carbohydrate bị xáo trộn, quá trình tổng hợp chất diệp lục và vitamin bị ức chế. Thiếu kẽm được loại bỏ bằng cách sử dụng phân bón có chứa kẽm. Độc tính của các hợp chất nhóm IIB tăng dần từ kẽm đến thủy ngân. Các hợp chất hòa tan trong nước gây kích ứng da và gây ngộ độc nếu ăn phải. Bản thân các kim loại cũng độc hại - khi hít phải hơi kẽm (không khí sản xuất kẽm) sẽ xuất hiện cơn sốt "kim loại". Ngộ độc hơi thủy ngân thời Trung Cổ được gọi là "căn bệnh điên cuồng của thợ làm mũ". Hàm lượng thủy ngân trong thực phẩm (ở biển, như ở Nhật Bản) dẫn đến bệnh minomata. Độc tính của thủy ngân có liên quan đến sự ngưng kết (dính vào nhau) của các tế bào hồng cầu, ức chế các enzym. Ví dụ, sự thăng hoa gây ra sự thay đổi về kích thước, tính mong manh thẩm thấu và giảm khả năng biến dạng của hồng cầu, điều cần thiết cho sự di chuyển của chúng qua các mao mạch. Độc tính của cadmium có liên quan đến ái lực của nó đối với axit nucleic. Do sự gắn kết của nó với DNA, chức năng của nó bị gián đoạn. Độc tính cadmium và thủy ngân mãn tính có thể làm suy giảm quá trình khoáng hóa xương. Các nguyên tố độc hại có thể thay thế canxi. Điều này dẫn đến sự hình thành apatit có cấu trúc không hoàn hảo do các thông số của thành phần tinh thể của mô xương bị biến dạng. Kết quả là sức mạnh của xương giảm sút. 46. Tính chất độc của các hợp chất nhóm IIB (Zn, Cd, Hg) Các hợp chất Zn, Cd, Hg có thể gây ra vi phạm chuyển hóa protein, biểu hiện ở việc giải phóng protein huyết tương qua thận (trong protein niệu). Tác dụng độc hại của các hợp chất nhóm IIB đối với cơ thể cũng là do các ion kim loại này tương tác với các nhóm sulfhydryl SH của protein, enzym và axit amin. Khi các ion kim loại tương tác với các nhóm SH, phân ly yếu và theo quy luật, các hợp chất không hòa tan được hình thành. Do đó, việc ngăn chặn các nhóm sulfhydryl dẫn đến ức chế hoạt động của enzyme và sự gấp nếp của protein. Ion kim loại hóa trị XNUMX đứng đồng thời hai nhóm SH. Trong các phản ứng kiểu này, các ion kim loại đóng vai trò là chất nhận và lưu huỳnh đóng vai trò là chất cho điện tử. Ái lực hóa học rõ rệt nhất đối với nhóm SH trong thủy ngân. Rõ ràng, điều này là do tính chất tạo phức của thủy ngân cao hơn và nó tạo liên kết mạnh hơn với lưu huỳnh. Nhóm SH là một phần của hơn 100 enzym, hoạt động của chúng có thể bị ngăn chặn do sự ngăn chặn của các nhóm này. Vì vậy, rõ ràng việc biết cơ chế ngăn chặn và các phương pháp điều trị thải độc cơ thể bằng kim loại là quan trọng như thế nào. Người ta biết rằng tính chất độc hại của các nguyên tố phụ thuộc vào dạng hóa học mà chúng xâm nhập vào cơ thể. Các dạng độc nhất là dạng hòa tan trong lipid và dễ dàng xâm nhập qua màng vào tế bào. Tài liệu mô tả một trường hợp ngộ độc thủy ngân hàng loạt ở Nhật Bản. Các hợp chất thủy ngân vô cơ được chuyển hóa thành methylmercury dưới tác dụng của các enzym vi sinh vật. Methylmercury tích tụ trong cá và sau đó xâm nhập vào cơ thể con người cùng với thức ăn. Dần dần cô đặc, methylmercury gây ra sự phá hủy không thể phục hồi trong cơ thể và tử vong. Việc sử dụng các hợp chất kẽm và thủy ngân trong y học dựa trên tác dụng làm se, làm săn da và khử trùng của chúng. Khi nhỏ mắt, dung dịch nước 0,25% của kẽm sunfat ZnSO được sử dụng.4. Trong nha khoa, kẽm clorua được sử dụng để làm lành các u nhú, để điều trị các màng nhầy bị viêm. Kẽm oxit ZnO cũng được sử dụng. Thủy ngân (II) clorua (thủy ngân clorua) rất độc, và các dung dịch nước của nó ở độ pha loãng cao (1: 1000) được sử dụng để khử trùng. Để điều trị các bệnh về da và lây truyền qua đường tình dục, thuốc mỡ có chứa oxit thủy ngân (II) HgO và thủy ngân sulfua (II) HgS được sử dụng. Thủy ngân (I) clorua (calomel) hòa tan kém trong nước và do đó hơi độc. Muối này được sử dụng trong thú y như một loại thuốc nhuận tràng. Thủy ngân ở điều kiện thường là kim loại lỏng, có thể hòa tan các kim loại khác. Trong trường hợp này, các hợp kim cứng - hỗn hống - được hình thành. Trong nha khoa, hỗn hống bạc và cadmium từ lâu đã được sử dụng để trám răng. Chúng trơ về mặt hóa học, dễ mềm khi đun nóng và do đó dễ hình thành. Nguồn tia cực tím - đèn thạch anh thủy ngân cho mục đích y tế - chứa thủy ngân ở dạng khí (hơi). Khi chiếu ánh sáng từ những chiếc đèn này trong phòng bệnh viện, các vi sinh vật có trong không khí sẽ bị tiêu diệt. Với sự trợ giúp của tia cực tím, các bệnh về da khác nhau được điều trị. Như vậy, theo tính chất hoạt động và tác động lên cơ thể, các kim loại thuộc nhóm IIB có thể được chia thành nguyên tố sống là Zn và nguyên tố tạp chất độc hại Cd và Hg. 47. Vai trò sinh học của các nguyên tố p nhóm IIIA. Việc sử dụng các hợp chất của chúng trong y học Boron là một nguyên tố vi lượng tạp chất, phần khối lượng của nó trong cơ thể con người là 105%. Boron tập trung chủ yếu ở phổi (0,34 mg), tuyến giáp (0,30 mg), lá lách (0,26 mg), gan, não (0,22 mg), thận, cơ tim (0,21 mg). Tác dụng sinh học của boron vẫn chưa được nghiên cứu đầy đủ. Boron được biết là có trong răng và xương, dường như ở dạng muối hòa tan ít của axit boric với các cation kim loại. Bo dư thừa có hại cho cơ thể con người. Có bằng chứng cho thấy thừa bo sẽ ức chế amylase, proteinase và làm giảm hoạt động của adrenaline. Theo hàm lượng trong cơ thể người (105%), nhôm thuộc nhóm tạp chất vi lượng. Nhôm tập trung chủ yếu trong huyết thanh, phổi, gan, xương, thận, móng, tóc, xâm nhập vào cấu trúc vỏ bọc thần kinh của não người. Lượng nhôm tiêu thụ hàng ngày của một người là 47 mg. Nhôm ảnh hưởng đến sự phát triển của biểu mô và mô liên kết, quá trình tái tạo mô xương, ảnh hưởng đến sự trao đổi phốt pho. Nhôm có ảnh hưởng đến quá trình enzym. Thừa nhôm trong cơ thể sẽ ức chế sự tổng hợp hemoglobin, vì do khả năng tạo phức khá cao, nhôm ngăn chặn các trung tâm hoạt động của các enzym tham gia vào quá trình tạo máu. Có bằng chứng cho thấy nhôm có thể xúc tác cho phản ứng chuyển hóa. Gali là một nguyên tố vi lượng tạp chất (hàm lượng trong cơ thể con người là 10-6-10-5%). Vai trò sinh học của gali đối với cơ thể sống hầu như không rõ ràng. Thallium là một nguyên tố có độc tính cao. Ion T1 có xu hướng, giống như Ag +, tạo ra các hợp chất mạnh với các phối tử chứa lưu huỳnh. Kết quả là nó rất độc vì nó ức chế hoạt động của các enzym chứa nhóm thio - SH. Ngay cả một lượng rất nhỏ hợp chất T1+ khi vào cơ thể cũng gây rụng tóc. Do sự gần nhau của bán kính K+ và T1+ chúng có tính chất tương tự nhau và có khả năng thay thế nhau trong các enzym. Các ion T1 và K là hợp lực. Điều này giải thích thực tế là các enzym pyruvate kinase và diol mất nước không chỉ được kích hoạt bởi các ion K, mà còn bởi các ion T1 (ion T1 thay thế cho ion K trong trung tâm xúc tác của các enzym). Sự hiệp lực của thallium và kali cũng được thể hiện ở chỗ, giống như ion K, ion T1 tích tụ trong hồng cầu. Là một thuốc giải độc cho ngộ độc với các ion T1, một phối tử chứa lưu huỳnh, axit amin cystine, được sử dụng. Kết luận, cần lưu ý rằng vai trò sinh học của các nguyên tố p nhóm IIIA chưa được nghiên cứu đầy đủ. Hiện nay người ta biết rằng bo và gali tương tác trong thực vật với polyphenol, chất ức chế sự phát triển của chúng, làm giảm độc tính của chất này. Vai trò chắc chắn của nhôm trong việc xây dựng biểu mô và mô liên kết, ngoài ra, nó còn tham gia vào các quá trình enzym, vừa là chất hoạt hóa vừa là chất ức chế, cũng đã được thiết lập. Ion T1 có khả năng ức chế nhiều enzym chứa lưu huỳnh. Hoạt tính sinh học của các nguyên tố nhóm IIIA chủ yếu liên quan đến khả năng tạo hợp chất phức tạp với các phối tử chứa oxy và photphat không hòa tan. 48. Vai trò sinh học của các nguyên tố p thuộc nhóm IVA. Việc sử dụng các hợp chất của chúng trong y học Theo hàm lượng trong cơ thể người (21,15%), cacbon thuộc nhóm chất dinh dưỡng đa lượng. Nó là một phần của tất cả các mô và tế bào ở dạng protein, chất béo, carbohydrate, vitamin, hormone. Theo quan điểm sinh học, carbon là chất hữu cơ số 1. Theo hàm lượng trong cơ thể người (103% -), silic thuộc nhóm tạp chất vi lượng. Phần lớn silic ở gan, tuyến thượng thận, tóc, thủy tinh thể. Vì silic điôxít tự nhiên hòa tan kém trong nước nên nó xâm nhập vào cơ thể con người không qua đường tiêu hóa mà theo không khí qua phổi dưới dạng bụi SiO.2. Với sự vi phạm chuyển hóa silicon, sự xuất hiện của tăng huyết áp, thấp khớp, loét, thiếu máu có liên quan. Trong thực hành y tế, silicon cacbua (IV) SiC được sử dụng - carborundum để mài chất trám và phục hình bằng nhựa. Silic đioxit SiO2 một phần của xi măng silicat. Cần lưu ý rằng bụi bao gồm các hạt than, silicon dioxide và nhôm khi tiếp xúc một cách có hệ thống với phổi sẽ gây ra bệnh - bệnh bụi phổi. Dưới tác động của bụi than là bệnh thán thư, bệnh nghề nghiệp của thợ mỏ. Hít phải bụi có chứa S1O2 , bệnh bụi phổi silic xảy ra dưới tác động của bụi nhôm - aluminosis. Theo hàm lượng trong cơ thể con người (10-6-10-5%) gecmani là một nguyên tố vi lượng. Vai trò sinh học vẫn chưa được làm sáng tỏ đầy đủ. Hợp chất gecmani giúp tăng cường quá trình tạo máu trong tủy xương. Người ta cũng biết rằng các hợp chất germanium có độc tính thấp. Theo hàm lượng trong cơ thể con người (104 %) thiếc đề cập đến các nguyên tố vi lượng. Thiếc xâm nhập vào cơ thể con người với các thực phẩm có tính axit được bảo quản trong lon thiếc có tráng một lớp thiếc. Trong môi trường axit, thiếc hòa tan và đi vào máu dưới dạng muối, có tác dụng gây độc. Tuy nhiên, trong các thí nghiệm trên chuột, người ta thấy rằng thiếc với một lượng nhỏ có tác dụng kích thích sự phát triển của chuột. Điều này tạo ra lý do để giả định sự cần thiết của nó đối với con người. Không nghi ngờ gì nữa, việc làm sáng tỏ vai trò sinh học của nguyên tố vi lượng này cần được nghiên cứu thêm. Trong thực hành y tế, các vật liệu khác nhau được sử dụng, đặc biệt là vật liệu trám răng có chứa thiếc. Vì vậy, thiếc là một phần của hỗn hống bạc (28%) để sản xuất chất trám răng. Chì và các hợp chất của nó, đặc biệt là các hợp chất hữu cơ, có độc tính cao. Các hợp chất chì ảnh hưởng đến quá trình tổng hợp protein, cân bằng năng lượng tế bào và bộ máy di truyền của nó. Nhiều yếu tố ủng hộ cơ chế biến tính. Người ta đã xác định rằng chì là một trong những nguyên tố có trong thực phẩm ảnh hưởng đến sự phát triển của sâu răng. Với thức ăn, nước uống, không khí trong khí quyển, một người hàng ngày hấp thụ tới 100 microgam chì. Chì được lắng đọng chủ yếu trong khung xương (lên đến 90%) ở dạng photphat ít tan. Phần khối lượng chì trong cơ thể con người là 106%. Lượng chì hấp thụ hàng ngày là 0,2-2 mg được coi là an toàn cho con người. Trong thực hành y tế, chì axetat (kem dưỡng da) và oxit chì (II) PbO (một phần của miếng dán chì đơn giản) đã được ứng dụng làm chất khử trùng làm se bên ngoài. 49. Vai trò sinh học của các nguyên tố p thuộc nhóm VA. Việc sử dụng các hợp chất của chúng trong y học (nitơ, phốt pho) Hàm lượng nitơ trong cơ thể con người (3,1%) đề cập đến các chất dinh dưỡng đa lượng. Nếu chỉ tính đến khối lượng chất khô của cơ thể (không có nước) thì hàm lượng nitơ trong tế bào là 8-10%. Yếu tố này là một phần không thể thiếu của axit amin, protein, vitamin, hormone. Nitơ hình thành liên kết phân cực với các nguyên tử hydro và carbon trong các phân tử sinh học. Trong nhiều phức hợp vô cơ sinh học (metalloenzyme), các nguyên tử nitơ liên kết các phần vô cơ và hữu cơ của phân tử theo cơ chế cho-nhận. Cùng với oxy và cacbon, nitơ tạo thành các hợp chất quan trọng - axit amin chứa cả nhóm amin có tính chất cơ bản và nhóm cacboxyl (-COOH) có tính axit. Nhóm amin cũng thực hiện một chức năng rất quan trọng trong phân tử axit nucleic. Ý nghĩa sinh lý của các bioligand chứa nitơ - porphyrin, chẳng hạn như huyết sắc tố, là rất lớn. Chu trình nitơ diễn ra trong sinh quyển. Chu trình nitơ rất quan trọng đối với nông nghiệp. Cần lưu ý thêm một tính chất quan trọng về mặt sinh học của nitơ - khả năng hòa tan của nó trong nước gần giống như oxy. Sự hiện diện của nitơ dư thừa trong máu có thể là nguyên nhân của sự phát triển của bệnh giảm áp. Với sự gia tăng nhanh chóng của các thợ lặn, áp suất giảm mạnh xảy ra, độ hòa tan của nitơ trong máu giảm tương ứng (định luật Henry), và các bong bóng của nitơ nguyên tố rời khỏi mạch máu làm tắc các mạch nhỏ, có thể dẫn đến tê liệt và tử vong. Theo hàm lượng trong cơ thể con người (0,95%), phốt pho thuộc về các chất dinh dưỡng đa lượng. Phốt pho là một nguyên tố hữu cơ và đóng một vai trò cực kỳ quan trọng trong quá trình trao đổi chất. Ở dạng phốt phát, phốt pho là thành phần thiết yếu của ATP nội bào. Nó là một phần của protein (0,5-0,6%), axit nucleic, nucleotide và các hợp chất hoạt tính sinh học khác. Phốt pho là cơ sở của bộ xương của động vật và con người (canxi orthophotphat, hydroxylapatite), răng (hydroxyapatite, fluorapatite). Nhiều phản ứng sinh tổng hợp được thực hiện do sự chuyển nhóm photphat từ chất nhận năng lượng cao sang chất có năng lượng thấp. Hệ thống đệm phosphat là một trong những hệ thống đệm chính trong máu. Các sinh vật sống không thể làm gì nếu không có phốt pho. Tầm quan trọng của phốt pho nằm ở chỗ các tế bào không thể sử dụng đường và axit béo làm nguồn năng lượng nếu không có quá trình phosphoryl hóa trước đó. Quá trình trao đổi photpho trong cơ thể liên quan mật thiết đến quá trình trao đổi canxi. Điều này được xác nhận bởi sự giảm lượng phốt pho vô cơ với sự gia tăng hàm lượng canxi trong máu (đối kháng). Nhu cầu phốt pho hàng ngày của con người là 1,3 g, phốt pho phổ biến trong các sản phẩm thực phẩm đến mức các trường hợp thiếu hụt rõ ràng (thiếu phốt phát) thực tế không được biết đến. Tuy nhiên, không phải tất cả phốt pho có trong thực phẩm đều có thể được hấp thụ, vì sự hấp thụ của nó phụ thuộc vào nhiều yếu tố: pH, tỷ lệ giữa canxi và phốt pho trong thực phẩm, sự hiện diện của axit béo trong thực phẩm, nhưng trước hết là hàm lượng vitamin D. Một số hợp chất của photpho được dùng làm thuốc. Cần lưu ý rằng các hợp chất phốt pho hữu cơ có chứa liên kết C-P là chất độc thần kinh mạnh và là một phần của tác nhân chiến tranh hóa học. 50. Vai trò sinh học của các nguyên tố p thuộc nhóm VA (asen, antimon, bitmut). Công dụng của chúng trong y học Theo hàm lượng trong cơ thể con người, asen thuộc nguyên tố vi lượng. Nó tập trung nhiều ở gan, thận, lá lách, phổi, xương, tóc. Hầu hết asen được tìm thấy trong mô não và cơ. Asen tích tụ trong xương và tóc và không được loại bỏ hoàn toàn trong vài năm. Tính năng này được sử dụng trong khám nghiệm pháp y để làm rõ nghi vấn liệu có bị đầu độc bằng hợp chất asen hay không. Việc xác định asen trong vật liệu sinh học được thực hiện trong một thiết bị đơn giản theo phản ứng Marsh: kẽm và axit clohydric được thêm vào vật thể sinh học. Hydro được giải phóng trong quá trình phản ứng làm giảm bất kỳ hợp chất asen nào thành arsine. Nếu hiđro được giải phóng có chứa hỗn hợp arsine thì AsH bị phân hủy khi đun nóng hỗn hợp khí3 : 2AsH3 = 2A ° + 3H2. và trên các bức tường của ống thoát khí, một lớp thạch tín màu đen sáng bóng được hình thành - một "gương thạch tín". Phản ứng Marsh rất nhạy và có thể phát hiện 7-107 g arsen. Với liều lượng tương đối lớn, các hợp chất asen rất độc. Như đã đề cập, tác động độc hại của các hợp chất asen là do sự ngăn chặn các nhóm sulfhydryl của các enzym và các chất có hoạt tính sinh học khác. Theo hàm lượng trong cơ thể con người (10%), antimon và bismuth là các nguyên tố vi lượng. Theo cách phân loại của V. V. Kovalsky, antimon và bismuth thuộc nhóm các nguyên tố vi lượng thường xuyên có trong cơ thể sống, nhưng vai trò sinh lý và sinh hóa của chúng thực tế không rõ ràng. Vai trò sinh lý của antimon rõ ràng là tương tự như của asen. Các ion của asen As và antimon Sb và ở mức độ thấp hơn, bitmut Bi là những chất đồng vận. Như vậy, người ta biết rằng ở các tỉnh địa hóa sinh có lượng arsen dư thừa trong cơ thể sinh vật, hàm lượng không chỉ arsen mà cả antimon cũng tăng lên. Đồng thời, cả hai yếu tố tích tụ trong tuyến giáp của cư dân, ức chế chức năng của nó và gây ra bệnh bướu cổ địa phương. Sự hợp lực của asen và antimon có liên quan đến khả năng tạo hợp chất của chúng với các phối tử chứa lưu huỳnh. Bismuth thiên về liên kết với các phối tử có chứa nhóm amin. Vì vậy, sự xâm nhập của các hợp chất bitmut hòa tan vào cơ thể dẫn đến ức chế các enzym amino và carboxypolypeptidase. Ăn phải các hợp chất antimon hòa tan trong nước, chẳng hạn như stibine SbH3, có tác dụng độc hại tương tự như các hợp chất asen. Các hợp chất bitmut cũng rất độc khi tiêm. Ví dụ, đối với chó, liều gây chết là 6 mg / kg thể trọng. Tuy nhiên, khi hầu hết các hợp chất antimon và bitmut đi vào đường tiêu hóa, chúng thực tế không có tác dụng độc hại. Độc tính yếu của các hợp chất này là do các muối Sb (III), Bi (III) trong đường tiêu hóa bị thủy phân tạo thành các sản phẩm hòa tan kém không được hấp thụ vào thành ống tiêu hóa. Đây là cơ sở cho việc sử dụng các loại thuốc antimon và bitmut, ví dụ, nitrat bitmut cơ bản. 51. Vai trò sinh học của các nguyên tố p thuộc nhóm VIA. Việc sử dụng các hợp chất của chúng trong y học Theo hàm lượng trong cơ thể người (62%), oxy thuộc nhóm chất dinh dưỡng đa lượng. Nó là không thể thiếu và là một trong những yếu tố quan trọng nhất tạo nên cơ sở của các hệ thống sống, đó là một chất hữu cơ. Oxy là một phần của một số lượng lớn các phân tử, từ những chất đơn giản nhất đến những chất tạo sinh học. Vai trò của oxy trong các quá trình sống là rất lớn, vì quá trình oxy hóa các chất dinh dưỡng (carbohydrate, protein, chất béo) với oxy đóng vai trò như một nguồn năng lượng cần thiết cho hoạt động của các cơ quan và mô của cơ thể sống. Hầu hết các phản ứng oxy hóa khử trong cơ thể diễn ra với sự tham gia của oxy và các dạng hoạt động của nó. Các chức năng thực bào (bảo vệ) của cơ thể cũng liên quan đến sự hiện diện của ôxy, và sự giảm hàm lượng ôxy trong cơ thể sẽ làm giảm các đặc tính bảo vệ của nó. Trong thực bào (tế bào có khả năng bắt giữ và tiêu hóa dị vật), oxy 02 bị khử thành superoxide. Trong thực hành y tế, oxy được sử dụng để hít vào trong các tình trạng đau đớn kèm theo thiếu oxy (thiếu oxy), các bệnh về đường hô hấp, hệ tim mạch, ngộ độc carbon monoxide (II) CO, axit hydrocyanic HCN, cũng như các bệnh suy giảm chức năng hô hấp . Được sử dụng rộng rãi trong thực hành lâm sàng là oxy hóa hyperbaric - sử dụng oxy dưới áp suất cao. Sự biến đổi dị hướng của oxy - ozon O3 như một chất oxy hóa rất mạnh được sử dụng để khử trùng cơ sở, khử trùng không khí và làm sạch nước uống. Theo nội dung trong cơ thể con người (0,16%), lưu huỳnh thuộc về các chất dinh dưỡng đa lượng. Giống như oxy, nó rất quan trọng. Nhu cầu hàng ngày của một người trưởng thành đối với lưu huỳnh là khoảng 4-5 g Lưu huỳnh là một phần của nhiều phân tử sinh học - protein, axit amin (cystine, cysteine, methionine, v.v.), hormone (insulin), vitamin (vitamin B1). Rất nhiều lưu huỳnh được tìm thấy trong caroten của tóc, xương, mô thần kinh. Trong cơ thể sống, lưu huỳnh, là một phần của axit amin, bị oxy hóa. Các sản phẩm cuối cùng của quá trình này chủ yếu là các sulfat. Ngoài ra, thiosunfat, lưu huỳnh xi măng và axit polythionic được hình thành. Theo hàm lượng trong cơ thể (10-5-10-7%) selen là một nguyên tố vi lượng. Một số nhà nghiên cứu coi nó là một yếu tố quan trọng. Selen đến từ thực phẩm - 55-110 mg mỗi năm. Selen tập trung chủ yếu ở gan và thận. Nồng độ selen trong máu là 0,001-0,004 mmol / l. Không còn nghi ngờ gì nữa, sự kết nối của selen với lưu huỳnh trong cơ thể sống. Ở liều lượng cao, selen chủ yếu tích tụ trong móng tay và tóc, dựa trên các axit amin chứa lưu huỳnh. Khả năng của selen trong việc bảo vệ cơ thể khỏi bị ngộ độc với thủy ngân Hg và cadmium Cd cũng được biết đến. Selen thúc đẩy liên kết của các kim loại độc hại này với các trung tâm hoạt động khác, với những trung tâm không bị ảnh hưởng bởi tác dụng độc hại của chúng. Một thực tế thú vị là mối quan hệ giữa hàm lượng selen cao trong chế độ ăn uống và tỷ lệ tử vong do ung thư thấp. Selenium là chất độc với liều lượng cao. Sự phân hủy các hợp chất selen ở động vật dẫn đến giải phóng ra chất dimethyl selen có độc tính cao, có mùi tỏi. 52. Vai trò sinh học của các nguyên tố p thuộc nhóm VIIA. Việc sử dụng các hợp chất của chúng trong y học (flo và clo) Theo hàm lượng trong cơ thể người, clo (0,15%) thuộc nhóm nguyên tố đa lượng, còn các nguyên tố còn lại thuộc nhóm này là nguyên tố vi lượng (hàm lượng - 105 %). Halogens ở dạng các hợp chất khác nhau là một phần của các mô của người và động vật. Clo và iốt là những nguyên tố không thể thay thế, trong khi phần còn lại là thành phần cấu tạo lâu dài của các mô. Khối lượng flo trong cơ thể người là khoảng 7 mg (~ 105 %). Hợp chất flo tập trung nhiều ở mô xương, móng tay, răng. Thành phần của răng bao gồm khoảng 0,01% flo, và phần lớn nó rơi vào men răng, có liên quan đến sự hiện diện của ít flopatit hòa tan trong đó. Cơ thể thiếu fluor sẽ dẫn đến sâu răng. Mối quan tâm đến hoạt động sinh học của flo chủ yếu liên quan đến các vấn đề về răng miệng, vì flo bảo vệ răng khỏi sâu răng. Cơ sở khoáng chất của mô răng (ngà răng) là hydroxyapatite, chlorapatite và fluorapatite. Thông thường, không phải bề mặt bên ngoài của răng, được bao phủ bởi một lớp men bị phá hủy, mà là các phần bên trong của ngà răng, lộ ra khi men răng bị hư hỏng. Có ý kiến cho rằng trong khi men răng bị hư hại nhẹ, việc đưa natri florua vào sẽ thúc đẩy sự hình thành fluorapatit, tạo điều kiện cho quá trình tái khoáng hóa những tổn thương đã bắt đầu. Natri florua NaF được sử dụng trong thực hành y tế như một tác nhân bên ngoài tại chỗ. Việc sử dụng NaF dựa trên sự hình thành của fluorapatit. Đồng thời, quá trình kiềm hóa môi trường khoang miệng cũng xảy ra, góp phần trung hòa axit do vi khuẩn tạo ra. Không chỉ thiếu mà thừa flo cũng có hại. Khi hàm lượng flo trong nước uống vượt quá tỷ lệ tối đa cho phép (1,2 mg/l), men răng trở nên giòn, dễ bị phá hủy và các triệu chứng khác của ngộ độc flo mãn tính xuất hiện - tăng độ giòn của xương, biến dạng xương và suy kiệt chung của cơ thể. Căn bệnh xảy ra trong trường hợp này được gọi là nhiễm độc fluorosis (nhiễm độc fluorosis). Cơ thể con người chứa khoảng 100 g (2790 mmol) clo. Chloridions đóng một vai trò sinh học quan trọng. Chúng hoạt hóa một số enzym, tạo môi trường thuận lợi cho hoạt động của enzym protolytic của dịch vị, cung cấp dòng ion qua màng tế bào, tham gia duy trì cân bằng thẩm thấu. Chloridion có bán kính tối ưu để thâm nhập qua màng tế bào. Điều này giải thích sự tham gia chung của nó với các ion Na và K trong việc tạo ra một áp suất thẩm thấu nhất định và điều hòa chuyển hóa nước-muối. Nhu cầu hàng ngày đối với natri clorua là 5-10 g Như đã thảo luận, NaCl cần thiết cho việc sản xuất axit clohydric trong dạ dày. Ngoài vai trò quan trọng của axit clohydric trong quá trình tiêu hóa, nó tiêu diệt các vi khuẩn gây bệnh khác nhau (tả, thương hàn). Nếu vi khuẩn xâm nhập vào dạ dày với một lượng nước lớn, thì do HCl loãng nên không có tác dụng kháng khuẩn, vi khuẩn sống sót. Từ đó dẫn đến bệnh tật cho cơ thể. Vì vậy, trong thời kỳ dịch bệnh, nước thô đặc biệt nguy hiểm. Khi lượng axit clohydric trong dạ dày không đủ, độ pH tăng cao và quá trình tiêu hóa bình thường bị rối loạn, ảnh hưởng nghiêm trọng đến sức khỏe con người. Với tính axit giảm của dịch vị, một dung dịch axit clohydric loãng được sử dụng trong y tế. Khi bị viêm dạ dày (viêm dạ dày), loét dạ dày tá tràng, sự tiết dịch vị tăng lên, độ chua của nó tăng lên. 53. Vai trò sinh học của các nguyên tố p thuộc nhóm VIIA. Việc sử dụng các hợp chất của chúng trong y học (brom, iot) Khối lượng brom trong cơ thể người là khoảng 7 mg. Nó được bản địa hóa chủ yếu trong các tuyến nội tiết, chủ yếu ở tuyến yên. Vai trò sinh học của các hợp chất brom trong hoạt động bình thường của cơ thể vẫn chưa được làm sáng tỏ một cách đầy đủ. Hợp chất brom sẽ ức chế chức năng của tuyến giáp và làm tăng hoạt động của vỏ thượng thận. Khi bromidions được đưa vào cơ thể, hệ thần kinh trung ương là nhạy cảm nhất. Bromidion tích tụ đồng đều trong các bộ phận khác nhau của não và hoạt động êm dịu với sự hưng phấn tăng lên. Chúng góp phần khôi phục sự cân bằng bị xáo trộn giữa các quá trình kích thích và ức chế. Bromidions được hấp thu dễ dàng ở đường tiêu hóa. Độc tính của bromidions thấp. Do sự bài tiết chậm ra khỏi cơ thể (trong vòng 30-60 ngày), chúng có thể tích tụ (tích tụ), dẫn đến sự phát triển của ngộ độc mãn tính, được gọi là bromism. Nếu các dấu hiệu của ngộ độc brom mãn tính xuất hiện, nên ngừng sử dụng các chế phẩm bromua ngay lập tức. Ngoài ra, một lượng lớn natri clorua được sử dụng (lên đến 25 g mỗi ngày) để tăng tốc độ giải phóng bromidions (nguyên tắc của Le Chatelier), và một thức uống phong phú được kê toa. Do mức độ nhạy cảm của từng cá nhân khác nhau, liều lượng của các chế phẩm brom thay đổi từ 0,05 đến 2,0 g. Iốt là một trong những nguyên tố sinh học thiết yếu và các hợp chất của nó đóng vai trò quan trọng trong quá trình trao đổi chất. Iốt ảnh hưởng đến quá trình tổng hợp một số protein, chất béo, hormone. Cơ thể con người chứa khoảng 25 mg iốt. Trong tổng số lượng iốt trong cơ thể, hơn một nửa là ở tuyến giáp. Hầu như tất cả iốt chứa trong tuyến này đều ở trạng thái liên kết (ở dạng hormone) và chỉ khoảng 1% trong số đó ở dạng iodidione. Tuyến giáp có thể tập trung I-25 lần - so với hàm lượng của nó trong huyết tương. Tuyến giáp tiết ra hormone thyroxine và triiodothyronine. Tuyến giáp hoạt động kém (suy giáp) có thể liên quan đến việc giảm khả năng tích tụ các ion iodua, cũng như thiếu iốt trong chế độ ăn uống (bệnh bướu cổ địa phương). Với bệnh bướu cổ lưu hành, các chế phẩm iốt được kê đơn: (kali iodua KI hoặc natri iodua NaI) với liều lượng tương ứng với nhu cầu iốt hàng ngày của con người (0,001 g kali iodua). Ở những nơi thiếu iốt, NaI hoặc K được thêm vào muối ăn để ngăn ngừa bệnh bướu cổ địa phương! (1-2,5 g trên 100 kg). Với sự gia tăng hoạt động của tuyến giáp (cường giáp), do tổng hợp quá nhiều hormone tuyến giáp, tốc độ tăng bất thường của quá trình trao đổi chất được quan sát thấy. Với sự không hiệu quả của các loại thuốc này trong điều trị cường giáp, người ta sử dụng một chế phẩm iốt phóng xạ 131 I, bức xạ này phá hủy các nang của tuyến giáp và do đó làm giảm sự tổng hợp dư thừa của các hormone. Tất cả các nguyên tố thuộc nhóm VIIA đều hoạt động về mặt sinh lý, clo và iốt không thể thiếu cho hoạt động sống của sinh vật. Flo được coi là một nguyên tố cần thiết cho hoạt động bình thường của các cơ thể sống. Trong cơ thể, các halogen có thể thay thế cho nhau, với các trường hợp có cả sức mạnh tổng hợp và đối kháng được quan sát thấy. 54. Bình xịt Sol khí là hệ thống phân tán với môi trường phân tán ở dạng khí. Tùy thuộc vào trạng thái tổng hợp của pha phân tán, sương mù được phân biệt - sol khí với pha phân tán lỏng; khói, bụi - sol khí với pha phân tán rắn; sương mù - sol khí với pha phân tán hỗn hợp. Kích thước hạt của pha phân tán của sol khí, phù hợp với phân loại của hệ phân tán, nằm trong khoảng từ 107 để 109 m Giống như các hệ thống phân tán khác, sol khí thu được bằng hai phương pháp: ngưng tụ và phân tán. phương pháp ngưng tụ Pha phân tán thu được từ pha hơi nhờ quá trình vật lý ngưng tụ các phân tử thành các hạt có kích thước dạng keo. Phương pháp phân tán Các hạt có kích thước dạng keo thu được bằng cách nghiền các cốt liệu lớn hơn. Sol khí có khả năng tán xạ ánh sáng. Các hạt của pha phân tán của sol khí không có lớp điện kép, nhưng các hạt của pha phân tán thường mang điện tích. Điện tích phát sinh do ma sát hoặc do sự hấp phụ của các ion khí. Cần lưu ý rằng rất thường các hạt aerosol (nhỏ và lớn) mang điện tích trái dấu. Sự phân tách các hạt theo kích thước trong khối lượng lớn sol khí dọc theo chiều cao có thể dẫn đến sự xuất hiện của một điện trường cường độ cao. Do đó, một sự phóng điện xảy ra trong các đám mây - sét. Sol khí là hệ thống không ổn định về mặt động học và tổng hợp, vì không có lớp điện kép ở ranh giới pha. Do đó, sol khí đông tụ với tốc độ nhanh hơn so với dung dịch lyosols. Trong y học, bình xịt được sử dụng trong liệu pháp xông, để bảo vệ vùng da bị tổn thương, khử trùng. Đôi khi sự hình thành của sol khí là rất không mong muốn. Các sol khí nguy hiểm cho sức khỏe con người được hình thành trong các ngành công nghiệp đúc, gốm sứ, trong quá trình khai thác và chế biến các loại khoáng sản khác nhau (quặng, than, amiăng, v.v.). Bình xịt có chứa các hạt than gây bệnh phổi - bệnh thán thư, oxit silic (IV) - bệnh bụi phổi silic, bệnh bụi phổi amiăng - amiăng. Các bệnh dị ứng gây ra bởi các sol khí được hình thành bởi phấn hoa của cây, bụi được tạo ra trong quá trình xử lý bông, lanh, gai dầu, v.v. Sự đình chỉ của vi khuẩn, nấm mốc và vi rút - aerosol vi sinh hoặc vi khuẩn - là một trong những cách truyền bệnh truyền nhiễm: lao phổi, cúm, các bệnh đường hô hấp cấp tính. Các tác động có hại đối với cơ thể con người được tạo ra bởi các sol khí hình thành trong quá trình đốt cháy nhiên liệu, pha phân tán bao gồm bồ hóng, hắc ín, tro và các hydrocacbon gây ung thư. Khói bụi đặc biệt nguy hiểm cho sức khỏe. Vì vậy, việc chống khói bụi, ô nhiễm bầu khí quyển ngày càng trở nên quan trọng. Làm sạch không khí từ sol khí đạt được bằng cách giới thiệu các công nghệ không thải - bẫy các hạt của pha phân tán bằng bộ lọc, lốc xoáy (máy hút bụi ly tâm) và điện trường cao áp. 55. Nhũ tương Nhũ tương là các hệ vi không đồng nhất, trong đó pha phân tán và môi trường phân tán là chất lỏng không trộn lẫn. Kích thước hạt của pha phân tán - giọt lỏng - nằm trong khoảng từ 104 đến 106 m. Tùy thuộc vào nồng độ của pha phân tán, nhũ tương được phân biệt: pha loãng, cô đặc và cô đặc cao. Tùy thuộc vào bản chất của pha phân tán và môi trường phân tán, có: 1) nhũ tương của chất lỏng không phân cực (DF) trong chất lỏng phân cực (DS) - nhũ tương trực tiếp, được gọi là nhũ tương loại thứ nhất hoặc nhũ tương loại "dầu / nước" (O / W); 2) nhũ tương của chất lỏng phân cực (DF) trong chất lỏng không phân cực (DS) - nhũ tương nghịch đảo, được gọi là nhũ tương loại thứ hai hoặc nhũ tương của loại "nước / dầu" (W / O). Ở đây, DF và DS lần lượt là pha phân tán và môi trường phân tán, "nước" là bất kỳ chất lỏng phân cực nào, "dầu" là không phân cực. Loại nhũ tương có thể được thiết lập: 1) đo độ dẫn điện; 2) trộn với lượng dư chất lỏng phân cực hoặc không phân cực; 3) nhuộm bằng thuốc nhuộm hòa tan trong nước hoặc hòa tan trong dầu; 4) bằng cách làm ướt và trải một giọt nhũ tương trên bề mặt kỵ nước hoặc ưa nước. Nhũ tương, giống như các hệ thống phân tán khác, có thể thu được bằng phương pháp ngưng tụ và phân tán. Nhũ tương là chất phân tán thô là hệ thống không ổn định về mặt động học và tổng hợp. Khi các giọt của pha phân tán va chạm với nhau, chúng hợp nhất (kết tụ). Kết quả của sự kết tụ, nhũ tương phân tách thành hai pha lỏng liên tục. Chất nhũ hóa được sử dụng để tăng tính ổn định của nhũ tương. Đây là những chất hoạt động bề mặt, là kết quả của sự hấp phụ ở ranh giới pha, làm giảm giá trị của sức căng liên vùng và tạo thành một màng hấp phụ mạnh về mặt cơ học. Nếu chất nhũ hóa là chất hoạt động bề mặt ion, thì nó truyền điện tích cùng dấu cho các giọt của pha phân tán và các giọt đẩy nhau. Loại nhũ tương được hình thành phụ thuộc vào đặc tính của chất nhũ hóa. Môi trường phân tán luôn là chất lỏng hòa tan tốt nhất hoặc làm ướt chất nhũ hóa. Muối của axit béo cao hơn, este của axit béo cao hơn và rượu polyhydric, amin mạch dài được sử dụng làm chất nhũ hóa. Nhũ tương được tìm thấy rộng rãi trong tự nhiên. Nhũ tương là sữa, kem, kem chua, bơ, lòng đỏ trứng, nước cây sữa, dầu thô. Nhũ tương chứa dược chất được sử dụng rộng rãi trong y học: loại XNUMX (O/W) dùng trong, loại XNUMX (W/M) dùng ngoài. Được biết, chất béo thực vật và động vật được cơ thể hấp thụ tốt hơn ở dạng nhũ tương (sữa). Trong trường hợp này, các dẫn xuất của axit cholic và deoxycholic hoạt động như chất nhũ hóa. Đôi khi cần phải phá vỡ nhũ tương kết quả. Sự phá vỡ nhũ tương được gọi là quá trình khử nhũ tương. Quá trình khử nhũ tương được thực hiện bằng cách tăng và giảm nhiệt độ, tiếp xúc với điện trường, ly tâm, thêm chất điện giải và các chất đặc biệt - chất khử nhũ tương. Chất khử nhũ tương là chất có hoạt tính bề mặt lớn hơn chất nhũ hóa, nhưng không có khả năng tạo thành lớp hấp phụ mạnh về mặt cơ học. 56. Chất hoạt động bề mặt dạng keo Chất hoạt động bề mặt dạng keo là những chất mà với cùng một dung môi, tuỳ theo điều kiện sẽ tạo thành dung dịch thật và dạng keo. Như đã đề cập, các phân tử chất hoạt động bề mặt là lưỡng tính. Chúng bao gồm các nhóm không phân cực và phân cực. Các gốc không phân cực, ví dụ, chuỗi hydrocarbon, không có ái lực với dung môi phân cực - nước, đối với các nhóm phân cực thì nó khá cao. Có một tương tác kỵ nước (van der Waals) giữa các nhóm không phân cực. Với chiều dài chuỗi khoảng 1022 nguyên tử cacbon do tương tác kỵ nước của các gốc hiđrocacbon và tương tác mạnh của các nhóm phân cực với nước, các phân tử chất hoạt động bề mặt liên kết với nhau và hình thành các mixen. Nồng độ tối thiểu của chất hoạt động bề mặt dạng keo, bắt đầu từ đó các micelle hình thành trong dung dịch của nó, được gọi là nồng độ micelle tới hạn (CMC). Hình dạng của các mixen tạo thành phụ thuộc vào nồng độ của dung dịch. Ở nồng độ thấp của chất hoạt động bề mặt dạng keo, các mixen hình cầu được hình thành. Sự gia tăng nồng độ của dung dịch chất hoạt động bề mặt dạng keo trước tiên dẫn đến sự gia tăng số lượng của chúng, sau đó dẫn đến sự thay đổi về hình dạng. Ở nồng độ cao hơn, thay vì các mixen hình cầu, các mixen hình trụ và hình phiến được hình thành. Giá trị CMC phụ thuộc vào các yếu tố khác nhau: bản chất của chất hoạt động bề mặt dạng keo, nhiệt độ và sự hiện diện của các tạp chất lạ, đặc biệt là chất điện ly. CMC có thể được xác định bởi các tính chất của dung dịch, phụ thuộc vào số lượng và kích thước của các hạt hoạt động động học, cụ thể là bởi sự thay đổi áp suất thẩm thấu, sức căng bề mặt, độ dẫn điện và các đặc tính quang học. Do kích thước của các hạt hoạt động động học (ion, phân tử, mixen) và số lượng của chúng thay đổi trong quá trình chuyển đổi "dung dịch thực - dung dịch keo", một điểm dừng tương ứng với CMC xuất hiện trên biểu đồ "đặc tính - nồng độ". Một trong những tính chất quan trọng nhất của dung dịch keo hoạt động bề mặt, do đó chúng được sử dụng rộng rãi trong các lĩnh vực khác nhau của nền kinh tế quốc dân và trong y học, là khả năng hòa tan. Cơ chế hòa tan bao gồm sự hòa tan các chất không phân cực trong lõi kỵ nước của các mixen. Hiện tượng hòa tan được sử dụng rộng rãi trong các lĩnh vực khác nhau của nền kinh tế quốc dân: trong công nghiệp thực phẩm, dược phẩm (để thu được các dạng dược chất lỏng). Trong hệ thống "nước - phospholipid", lắc và khuấy tạo thành các mixen hình cầu - liposome. Các phân tử phospholipid tạo thành màng kép trong liposome, trong đó các nhóm phân cực đối mặt với nước và các nhóm không phân cực đối diện với nhau. Liposome có thể được coi là một mô hình của màng sinh học. Với sự giúp đỡ của họ, có thể nghiên cứu tính thấm của màng và ảnh hưởng của các yếu tố khác nhau đến nó đối với các hợp chất khác nhau. Liposome được sử dụng rộng rãi để phân phối thuốc có mục tiêu đến một số cơ quan hoặc khu vực bị ảnh hưởng. Các liposome có thể vận chuyển thuốc vào tế bào. Màng liposomal được sử dụng trong nghiên cứu miễn dịch học để nghiên cứu sự tương tác giữa kháng thể và kháng nguyên. Tác giả: Drozdova M.V., Drozdov
▪ Các bệnh thần kinh. Ghi chú bài giảng ▪ Teria của tổ chức. Giường cũi ▪ Lịch sử của y học. Ghi chú bài giảng
Máy tỉa hoa trong vườn
02.05.2024 Kính hiển vi hồng ngoại tiên tiến
02.05.2024 Bẫy không khí cho côn trùng
01.05.2024
▪ phần của trang web Máy dò cường độ trường. Lựa chọn các bài viết ▪ bài viết Tôi buồn...vì bạn đang vui. biểu hiện phổ biến ▪ bài viết Người Celt sống ở Anh trong bao lâu? đáp án chi tiết ▪ bài báo An toàn lao động của công nhân lâm nghiệp ▪ bài viết Đập máy dò kim loại, lý thuyết. Bách khoa toàn thư về điện tử vô tuyến và kỹ thuật điện ▪ bài báo Bộ thu trên bộ khuếch đại hoạt động. Bách khoa toàn thư về điện tử vô tuyến và kỹ thuật điện
Trang chủ | Thư viện | bài viết | Sơ đồ trang web | Đánh giá trang web www.diagram.com.ua |






 Arabic
Arabic Bengali
Bengali Chinese
Chinese English
English French
French German
German Hebrew
Hebrew Hindi
Hindi Italian
Italian Japanese
Japanese Korean
Korean Malay
Malay Polish
Polish Portuguese
Portuguese Spanish
Spanish Turkish
Turkish Ukrainian
Ukrainian Vietnamese
Vietnamese

 Xem các bài viết khác razdela
Xem các bài viết khác razdela 